Оксидът не се разтваря във вода. Успехите на съвременното естествознание. Химични взаимодействия за класа на средните соли
Усложняването на структурата на веществото в класификацията на неорганичните съединения се извършва в следната последователност: елементи ® оксиди (основни, киселинни, амфотерни) ® хидроксиди (основи и киселини) ® соли (средни, киселинни, основни).
Оксиди Съединенията са изградени от два елемента, единият от които е кислород.. По химическа природа оксидите се разделят на три групи:
основни оксиди, Na 2 O, MgO, CaO, FeO, NiO, Fe 2 O 3, …;
киселинни оксиди, SO 2, SO 3, CO 2, Mn 2 O 7, P 2 O 5, ...;
амфотерни оксиди, Al 2 O 3 , ZnO, BeO, SnO, Cr 2 O 3 , PbO
твърди оксиди K 2 O, Al 2 O 3, P 2 O 5, ...
течност: SO 3, N 2 O 4, ...
газообразни: CO 2 , NO 2 , SO 2 ...
Според разтворимостта си във вода оксидите се делят на:
На разтворим(SO 2 , CO 2 , K 2 O, Na 2 O, Rb 2 O, CaO)
И неразтворим :( CuO, FeO, NiO, SiO 2, Al 2 O 3, MoO 3, амфотерни оксиди)
1.1.1 Основни оксиди
ОсновнотоНаречен оксидикоито реагират с киселини, за да образуват сол и вода. Основните оксиди включват калиев оксид K 2 O, калциев оксид CaO, манганов (II) оксид MnO, меден (I) оксид Cu 2 O и др.
Основните оксиди реагират с киселини, за да се образуват
сол и вода; MnO + 2HCl Þ MnCl2 + H2O; Fe 2 O 3 + 3H 2 SO 4 \u003d Fe 2 (SO 4) 3 + 3H 2 O.
Основните оксиди взаимодействат с киселинните оксиди
образуване на сол: CaO + CO 2 = CaCO 3; 3Na 2 O + P 2 O 5 \u003d 2Na 3 PO 4.
2FeO + SiO 2 = Fe 2 SiO 4
Оксидите на алкалните и алкалоземните метали взаимодействат с вода:
K 2 O + H 2 O \u003d 2KOH; CaO + H 2 O + Ca (OH) 2
Може също така да се дефинират основни оксиди като тези оксиди, които съответстват на основи. Например мангановият оксид MnO съответства на хидроксида Mn(OH) 2 . Основните оксиди са оксидите с-, е-И д-елементи в най-ниска степен на окисление и оксиди на някои стр- елементи.
Киселинни оксиди
Киселинни оксидимогат да се назоват оксидите, на които отговарят киселините. И така, серен оксид (VI) SO 3 съответства на сярна киселина H 2 SO 4, най-високият оксид на манган (VII) Mn 2 O 7 - манганова киселина HMnO 4.
(А). Общо свойство на всички киселинни оксиди е способността им да взаимодействат с основи, за да образуват сол и вода:
CO 2 + 2NaOH \u003d Na 2 CO 3 + H 2 O, за да напишете формулата на солта, трябва да знаете
Коя киселина съответства на този оксид
N2O5 + Ba(OH)2 = Ba(NO3)2 + H2O; SO 3 + Ca (OH) 2 \u003d CaSO 4 + H 2 O
[ HNO3]
(б). Киселинните оксиди взаимодействат с основните оксиди и образуват соли: CaO + CO 2 = CaCO 3 ; 3Na 2 O + P 2 O 5 \u003d 2Na 3 PO 4.
(V). По отношение на водата киселинните оксиди могат да бъдат добре и слабо разтворими. Разтворимите оксиди включват въглероден оксид (IV) CO 2 , серни оксиди и др. Слабо разтворимите киселинни оксиди включват силициев оксид SiO 2 , молибденов оксид MoO 3 и др. При разтваряне във вода се образуват киселини: CO 2 + H 2 O \u003d H 2 CO 3; SO 3 + H 2 O \u003d H 2 SO 4
31 Московски държавен технически университет "Ломоносов". Н.Е. Бауман
2 Първи Московски държавен медицински университет. ТЯХ. Сеченов
3 Московски държавен педагогически университет
Въпросите за ецване на оксидни отлагания от повърхността на стомани, съдържащи кобалт и желязо, винаги са били от практическо значение и са били актуални. След като са проучили голямо количество материали по този въпрос, авторите заявяват, че някои аспекти на проблема все още не са напълно проучени (те включват влиянието на характеристиките на електролитните разтвори, идентифицирането на механизма на действие на тези фактори). Кобалтовите и железните оксиди се използват широко като катализатори за различни химични процеси (окисляване на метан и въглероден оксид, дехидрогениране на парафини и др.). Техните свойства зависят от характеристиките на повърхността, която определя кинетиката на разтваряне на оксида. Експерименталните изследвания върху ефекта на минералните киселини (по-специално H2SO4) върху скоростта на хетерогенна реакция (Co3O4 и Fe3O4 в кисела среда) разкриват естеството на ограничаващия етап, който се състои в образуването на повърхностни съединения под формата - и последващото им преминаване в електролитен разтвор. Разработен е и системен анализ на кривите на разтваряне на оксиди за изчисляване на кинетичните параметри: енергия на активиране и ред на реакция за водородни йони и сулфатни йони.
кобалтов оксид
железен оксид
кинетика
разтваряне
моделиране
Модел на Бартън-Странски
Метод на Хоуген-Уотсън
1. Бокщейн Б.С., Менделев М.И., Похвиснев Ю.В. Физикохимия: термодинамика и кинетика. - М.: Издателство "MISIS", 2012. - 258 с.
2. Бътлър Дж. Йонно равновесие. - Л.: Химия, 1973. - 448 с.
3. Delmon B. Кинетика на хетерогенни реакции. – М.: Мир, 1972. – 555 с.
4. Barre P. Кинетика на хетерогенни процеси. – М.: Мир, 1976. – 400 с.
5. Киселев М.Ю. Механизъм и кинетика на разтваряне на пирит по метода на електрохимичното хлориране. Минно списание. - 2010. - № 4. - С. 101-104.
6. Корценштейн Н.М., Самуилов Е.В. Обемна кондензация в хетерогенни реакции // Colloid journal. - 2013. - Т. 75, № 1. - 84 с.
7. Колесников В.А., Капустин В.А., Капустин Ю.И., Исаев М.К., Колесников А.В. Метални оксиди – перспективни материали за електрохимични процеси // Стъкло и керамика. - 2016. - № 12. - С. 23–28.
8. Якушева Е.А., Горичев И.Г., Атанасян Т.К., Изотов А.Д. Изследване на кинетиката на разтваряне на кобалтови оксиди (Co3O4, Co2O3) при различни концентрации на H2SO4, HCl, EDTA и pH // Волгоград: Резюмета XIX Mend. конгрес по общ и приложна химия. - 2011. - Т. 3 - С. 366.
9. Якушева Е.А., Горичев И.Г., Атанасян Т.К., Линер Ю.А. Кинетика на разтваряне на кобалтови оксиди в кисела среда // Метали. - 2010. - № 2. - С. 21–27.
10. Якушева Е.А., Горичев И.Г., Атанасян Т.К., Плахотная О.Н., Горячева В.Н. Моделиране на кинетични процеси на разтваряне на кобалтови и медни оксиди в сярна киселина // Бюлетин на MSTU im. Н.Е. Бауман. сер. Естествени науки. - 2017. - № 3. - C. 124–134.
Експерименталните изследвания на разтварянето на оксидните фази позволяват да се опишат подробно процесите на поведение на твърда фаза в кисела среда, да се обяснят явленията, които се случват на повърхността на оксидите, като се вземат предвид техните киселинно-базови характеристики и механизма на разтваряне, за моделиране на топо химична реакция.
Цел на изследванетосе състои в изучаване и моделиране на процеса на разтваряне на Co3O4 и Fe3O4 в сярна киселина.
Материали и методи на изследване
За изследване са взети проби с тегло 500 mg с d = 80÷100 µm. Идентифицирането на оксидите се извършва чрез рентгенофазов, инфрачервен и термичен анализ.
За да се изясни механизмът на разтваряне на твърди проби от метални оксиди в кисела среда, експериментът беше проведен в устройство (термостатно контролиран реактор с обем 0,5 l) за изследване на кинетиката на разтваряне на твърди проби, като се изключи влиянието на всякакви неконтролирани фактори върху изследваното явление. Температурата на експеримента е 363 K. Експериментът се провежда при различни стойности на pH и концентрации на минерална киселина.
На определени интервали от течната фаза се взема проба от реакционния съд със стъклен филтър на Шот. Концентрацията на кобалтовите йони се определя спектрофотометрично (спектрофотометър UV-3100) с амониев тиоцианат, а на желязото - с о-фенантролин.
Получените експериментални данни за ефекта на концентрацията на киселина върху скоростта на разтваряне на кобалтовия оксид Co3O4 и Fe3O4 са показани на фиг. 1 (точки - експериментални данни, линии - резултат от симулация). Фракцията на разтвореното вещество a се изчислява с помощта на уравнението: a = Dt/D∞.

Ориз. 1. а) зависимост на съотношението на разтворения оксид Co3O4 от времето при различни концентрации на сярна киселина (mol / l): 1 - 10,0; 2 - 5,93; 3 - 2,97; 4 - 1,0; 5 - 0,57; 6 - 0,12; Т = 363.2 К; б) зависимост на съотношението на разтворения оксид Fe3O4 от времето при различни концентрации на сярна киселина (mol/l): 1 - 10,3; 2 - 7,82; 3 - 3,86; 4 - 2,44; T = 293 К
Резултати от изследването и дискусия
Изчисляване на кинетични параметри. Анализът на експерименталните кинетични данни беше извършен с помощта на уравненията на хетерогенната кинетика, което позволи да се определят редовете на реакциите за различни йони (ni), специфичната скорост на разтваряне (Wi), нейната зависимост от концентрацията на разтвора , и енергията на активиране на реакциите (Ea).
Кинетиката на хетерогенните реакции се основава на задължителното отчитане на промените в повърхността на частиците в процеса на разтваряне във времето, освен това, като правило, хетерогенните реакции се характеризират с постоянна скорост във времето (1) .
В този случай скоростта на разтваряне на оксида може да бъде представена чрез уравнението:
където Wi е специфичната скорост на разтваряне; f(α) е функция, която отчита как повърхността на оксида се променя с времето.
За да изясним механизма на разтваряне и да симулираме това явление, ние взехме модела на Barton - Stranski (2):
![]() , (2)
, (2)
където А е константа. Стойността му е право пропорционална на броя на активните центрове на повърхността на една оксидна частица.
За намиране на стойностите на променливите W и A бяха използвани методите на нелинейния регресионен анализ и компютърната програма MathCad.
маса 1
Специфична скорост на разтваряне на Co3O4 и Fe3O4 оксиди в зависимост от концентрацията на H2SO4
От данните на таблицата и фиг. 2 (точки - експериментални данни, линии - резултат от моделиране по уравнение (3)) следва, че кобалтовият оксид Co3O4 се разтваря по-бързо в сярна киселина от железния оксид Fe3O4. Реакционният ред по отношение на водородните йони за двата оксида е приблизително 0,5. (всички резултати са получени на базата на модела на Бартън - Странски).


Ориз. 2. а) зависимост на логаритъма на скоростта (log W) от логаритъма на концентрацията (log C(H2SO4)) при разтваряне на Co3O4 в сярна киселина; б) зависимост на логаритъма на скоростта (log W) от логаритъма на концентрацията (log C(H2SO4)) при разтварянето на Fe3O4 в сярна киселина
Получените данни позволяват да се опише връзката между специфичната скорост на разтваряне на оксидите Co3O4 и Fe3O4 и концентрацията на H2SO4 чрез обобщеното уравнение
![]() , (3)
, (3)
където ≡, W0 - константа на скоростта на разтваряне, K1, K2 - константи.
Моделиране на механизма на разтваряне на кобалтови и железни оксиди в неорганична киселина. Разтварянето на оксиди в киселини се извършва върху повърхностните дефекти на кристалната решетка, така наречените активни центрове на разтваряне на оксиди, адсорбиращи H+ йони и H+…A- йонни двойки.
Методът Hougen-Watson дава възможност да се симулира ефектът на рН и концентрацията на киселина върху скоростта на разтваряне на оксидите.
В този случай скоростта на разтваряне на кобалтовия и железния оксид ще бъде изразена с уравнението:
Предполага се, че върху повърхността на оксидите се образуват частици от метални хидроксокомплекси със същия състав като тези в разтвора. За да изчислим концентрацията на хидроксокомплексите, използвахме уравненията на материалния баланс в реакциите на хидролиза по отношение на йони на водород, кобалт и желязо; уравнения на хидролиза за всички стъпки за изчисляване на константите на хидролиза. Методът Hougen-Watson предполага, че зависимостта на концентрацията на йони върху повърхността на оксидите и в разтвора се подчинява на изотермата на Langmuir, което прави възможно свързването на повърхностните и обемните концентрации на йони (уравнение (5)).
Зависимостта на специфичната скорост на разтваряне на кобалтовите оксиди Co3O4 и Fe3O4 в разредена сярна киселина се изразява с уравнения (5-7).
Концентрацията на йони и може да се изрази чрез общата концентрация на Co3+ и Fe3+ йони, ако се установи тяхното съдържание в разтвора. В този случай и . Тогава скоростта е
Ако симулираме процеса на разтваряне на оксида и приемем, че йоните и действат като повърхностноактивни частици, тогава зависимостта на скоростта на процеса от концентрацията на йони ще изглежда така (a1 е броят на йоните в разтвора).
нараства
разтворимост на оксиди и
хидроксиди
Подгрупа
Разтваряйки се, йонните оксиди влизат в химично взаимодействие с вода, образувайки съответните хидроксиди:
Na 2 O + H 2 O → 2NaOH
CaO + H 2 O → Ca (OH) 2
много силен
основна оксидна основа
Хидроксидите на алкалните и алкалоземните метали са силни основи и напълно се дисоциират във вода на метални катиони и хидроксидни йони:
NaOH Na + + OH –
Тъй като концентрацията на OH - йони се увеличава, разтворите на тези вещества имат силно алкална среда (pH>>7); те се наричат алкали.
Втора група силно разтворимвъв водни оксиди и съответните им хидрокси съединения - молекулни оксиди и киселини с ковалентен тип химични връзки. Те включват съединения на типични неметали в най-висока степен на окисление и някои d-метали в степен на окисление: +6, +7. Разтворимите молекулни оксиди (SO 3, N 2 O 5, Cl 2 O 7, Mn 2 O 7) взаимодействат с вода, за да образуват съответните киселини:
SO 3 + H 2 O H 2 SO 4
серен оксид (VI) сярна киселина
силна киселина силна киселина
N 2 O 5 + H 2 O 2HNO 3
азотен оксид (V) азотна киселина
Mn 2 O 7 + H 2 O 2HMnO 4
манганов(VII) оксид манганова киселина
Силните киселини (H 2 SO 4, HNO 3, HClO 4, HClO 3, HMnO 4) в разтвори напълно се дисоциират на H + катиони и киселинни остатъци:
Етап 2: H 2 PO 4 – H + + HPO 4 2–
K 2 \u003d (= 6,2 ∙ 10 -8;
3-ти етап: HPO 4 2– H + + PO 4 3–
K 3 \u003d () / \u003d 4,4 ∙ 10 -13,
където K 1 , K 2 , K 3 са константите на дисоциация на ортофосфорната киселина съответно в първия, втория и третия етап.
Константата на дисоциация (таблица 1 от приложението) характеризира силата на киселината, т.е. способността му да се разлага (дисоциира) на йони в средата на даден разтворител при дадена температура. Колкото по-голяма е константата на дисоциация, толкова повече равновесието се измества към образуването на йони, толкова по-силна е киселината, т.е. в първия етап дисоциацията на фосфорната киселина върви по-добре, отколкото във втория и съответно в третия етап.
Умерено разтворимите оксиди на сярата (IV), въглерода (IV), азота (III) и др. образуват във вода съответните слаби киселини, които частично се дисоциират.
CO 2 + H 2 O H 2 CO 3 H + + HCO 3 -
SO 2 + H 2 O H 2 SO 3 H + + HSO 3 -
N 2 O 3 + H 2 O 2HNO 2 H + + NO 2 -
слаб-слаб
киселинни киселини
Реакция на неутрализация
Реакцията на неутрализация може да се изрази със следната схема:
| H 2 O |
(основа или (киселина или киселина-
основен оксид) ни оксид)
5.3.1. Основни свойства на съединениетопоказват оксиди и хидроксиди на s-метали (с изключение на Be), d-метали в степен на окисление (+1, +2) (с изключение на Zn) и някои p-метали (виж фиг. 3).
| VIIIA | ||||||||||
| Аз А | II А | IIIA | IVA | Вирджиния | ЧРЕЗ | VIIA | ||||
| Ли |  Бъда Бъда | б | ° С | н | О | Е | ||||
Ориз. 3. Киселинно-алкални свойства на оксидите и съответните им хидрокси съединения
Характерно свойство на основните съединения е способността им да взаимодействат с киселини, киселинни или амфотерни оксиди, за да образуват соли, например:
KOH + HCl KCl + H2O
Ba(OH) 2 + CO 2 BaCO 3 + H 2 O
2NaO + Al 2 O 3 2NaAlO 2 + H 2 O
В зависимост от броя на протоните, които могат да се прикрепят към основата, има единични киселинни основи (например LiOH, KOH, NH 4 OH), двукиселинни основи и др.
За поликиселинните основи реакцията на неутрализация може да протича на етапи с образуването първо на основни и след това на междинни соли.
Me(OH) 2 MeOHCl MeCl 2
хидроксид NaOH основен NaOH среда
метална сол сол
Например:
Етап 1: Co(OH) 2 + HCl CoOHCl + H 2 O
хидроксокобалт(II)
(основна сол)
Етап 2: Co(OH)Cl + HCl CoCl2 + H2O
кобалт(II)
5.3.2. Свойства на киселинните съединенияпоказват оксиди и киселини на неметали, както и d-метали в степен на окисление (+5, +6, +7) (виж фиг. 3).
Характерно свойство е способността им да взаимодействат с основи, основни и амфотерни оксиди, за да образуват соли, например:
2HNO 3 + Cu(OH) 2 → Cu(NO 3) 2 + 2H 2 O
2HCl + CaO → CaCl 2 + H 2 O
H 2 SO 4 + ZnO → ZnSO 4 + H 2 O
CrO 3 + 2NaOH → Na 2 CrO 4 + H 2 O
Според наличието на кислород в състава си киселините се делят на кислородсъдържащи(например H 2 SO 4, HNO 3) и аноксичен(HBr, H2S). Според броя на водородните атоми, съдържащи се в киселинната молекула, които могат да бъдат заменени с метални атоми, се разграничават едноосновни киселини (например хлороводород HCl, азотиста киселина HNO 2), двуосновни (сярен H 2 SO 3, въглища H 2 CO 3), триосновен (ортофосфорен H 3 PO 4) и др.
Многоосновните киселини се неутрализират поетапно с образуването на първоначално киселинни, а след това средни соли:
H 2 X NaHX Na 2 X
многоосновна киселинна среда
кисела сол сол
Например, ортофосфорната киселина може да образува три вида соли, в зависимост от количественото съотношение на взетата киселина и основа:
а) NaOH + H 3 PO 4 → NaH 2 PO 4 + H 2 O;
1:1 дихидроген фосфат
b) 2NaOH + H3PO4 → Na2HPO4 + 2H2O;
2:1 хидроген фосфат
в) 3NaOH + H 3 PO 4 → Na 3 PO 4 + 3H 2 O.
3:1 ортофосфат
5.3.3. Амфотерни оксиди и хидроксидиобразуват Be, p-метали, разположени близо до „амфотерния диагонал“ (Al, Ga, Sn, Pb), както и d-метали в степени на окисление (+3, +4) и Zn (+2) (виж фиг. 3 ).
Слабо разтворими, амфотерните хидроксиди се дисоциират както в основни, така и в киселинни типове:
2H + + 2– Zn(OH) 2 Zn 2+ + 2OH –
Следователно амфотерните оксиди и хидроксиди могат да взаимодействат както с киселини, така и с основи. При взаимодействие с по-силни киселини амфотерните съединения проявяват свойствата на основите.
ZnO + SO 3 → ZnSO 4 + H 2 O
киселина
Zn(OH) 2 + H 2 SO 4 → ZnSO 4 + H 2 O
основна киселина
връзки
При взаимодействие със силни основи амфотерните съединения проявяват свойствата на киселини, образувайки съответните соли. Съставът на солта зависи от условията на реакцията. При сливане се образуват прости "дехидратирани" соли.
2NaOH + Zn(OH) 2 → Na 2 ZnO 2 + H 2 O
основа киселина натриев цинкат
съединение
2NaOH + ZnO → Na 2 ZnO 2 + H 2 O
Във водни разтвори на алкали се образуват комплексни соли:
2NaOH + Zn(OH) 2 → Na 2
(воден тетрахидроксоцинкат
Съвременната химическа наука е голямо разнообразие от клонове и всеки от тях, в допълнение към теоретичната база, има голямо приложно и практическо значение. Каквото и да пипнеш, всичко наоколо е продукт на химическо производство. Основните раздели са неорганична и органична химия. Помислете какви основни класове вещества се класифицират като неорганични и какви свойства имат.
Основни категории неорганични съединения
Те включват следното:
- Оксиди.
- Сол.
- Основи.
- Киселини.
Всеки от класовете е представен от голямо разнообразие от неорганични съединения и е важен в почти всяка структура на човешката икономическа и промишлена дейност. Всички основни свойства, характерни за тези съединения, намиращи се в природата и получаващи се изучават в училищния курс по химия без провал, в 8-11 клас.
Има обща таблица на оксиди, соли, основи, киселини, която представя примери за всяко от веществата и тяхното агрегатно състояние, съществуващи в природата. Той също така показва взаимодействия, които описват химичните свойства. Въпреки това ще разгледаме всеки от класовете поотделно и по-подробно.
Група съединения - оксиди
4. Реакции, в резултат на които елементите променят CO
Me + n O + C = Me 0 + CO
1. Реактивна вода: образуване на киселина (SiO 2 изключение)
KO + вода = киселина
2. Реакции с основи:
CO 2 + 2CsOH \u003d Cs 2 CO 3 + H 2 O
3. Реакции с основни оксиди: образуване на соли
P 2 O 5 + 3MnO \u003d Mn 3 (PO 3) 2
4. OVR реакции:
CO 2 + 2Ca \u003d C + 2CaO,
Те показват двойни свойства, взаимодействат по принципа на киселинно-базовия метод (с киселини, основи, основни оксиди, киселинни оксиди). Те не взаимодействат с водата.
1. С киселини: образуване на соли и вода
AO + киселина \u003d сол + H 2 O
2. С основи (алкали): образуване на хидроксокомплекси
Al 2 O 3 + LiOH + вода \u003d Li
3. Реакции с киселинни оксиди: получаване на соли
FeO + SO 2 \u003d FeSO 3
4. Реакции с RO: образуване на соли, топене
MnO + Rb 2 O = двойна сол Rb 2 MnO 2
5. Реакции на синтез с основи и карбонати на алкални метали: образуване на соли
Al 2 O 3 + 2LiOH \u003d 2LiAlO 2 + H 2 O
Всеки висш оксид, образуван както от метал, така и от неметал, когато се разтвори във вода, дава силна киселина или основа.
Органични и неорганични киселини
В класическия звук (въз основа на позициите на ED - електролитна дисоциация - киселините са съединения, в водна средадисоцииращи се на катиони Н + и аниони на киселинни остатъци An - . Днес обаче киселините са внимателно изследвани при безводни условия, така че има много различни теории за хидроксидите.
Емпиричните формули на оксиди, основи, киселини, соли се състоят само от символи, елементи и индекси, показващи тяхното количество в дадено вещество. Например неорганичните киселини се изразяват с формулата Н + киселинен остатък n-. органична материяимат различно теоретично представяне. В допълнение към емпиричната е възможно да се запише пълна и съкратена структурна формула за тях, която ще отразява не само състава и количеството на молекулата, но и подреждането на атомите, връзката им един с друг и основните функционална група за карбоксилни киселини -СООН.
В неорганичните всички киселини се разделят на две групи:
- аноксични - HBr, HCN, HCL и други;
- кислородсъдържащи (оксокиселини) - HClO 3 и всичко, където има кислород.
Също така неорганичните киселини се класифицират по стабилност (стабилни или стабилни - всичко с изключение на въглеродни и сярни, нестабилни или нестабилни - въглеродни и сярни). По сила киселините могат да бъдат силни: сярна, солна, азотна, перхлорна и други, както и слаби: сероводородна, хипохлорна и други.

Органичната химия изобщо не предлага такова разнообразие. Киселините, които са органични по природа, са карбоксилни киселини. Тяхната обща черта е наличието на функционална група -СООН. Например HCOOH (антин), CH 3 COOH (оцетен), C 17 H 35 COOH (стеаринов) и други.
Има редица киселини, които са особено внимателно подчертани при разглеждането на тази тема в училищен курс по химия.
- Сол.
- Азот.
- Ортофосфорен.
- Бромоводородна.
- Въглища.
- йод.
- Сярна.
- Оцетна киселина или етан.
- Бутан или масло.
- Бензоен.
Тези 10 киселини в химията са основните вещества на съответния клас както в училищния курс, така и като цяло в промишлеността и синтеза.

Свойства на неорганичните киселини
Основните физични свойства трябва да се припишат предимно на различно състояние на агрегиране. В края на краищата има редица киселини, които имат формата на кристали или прах (борна, ортофосфорна) при нормални условия. По-голямата част от известните неорганични киселини са различни течности. Точките на кипене и топене също варират.
Киселините могат да причинят тежки изгаряния, тъй като имат силата да разрушават органичните тъкани и кожата. За откриване на киселини се използват индикатори:
- метилоранж (в нормална среда - оранжево, в киселини - червено),
- лакмус (в неутрално - виолетово, в киселини - червено) или някои други.
Най-важните химични свойства включват способността за взаимодействие както с прости, така и със сложни вещества.
| С какво си взаимодействат? | Пример за реакция |
1. С прости вещества-метали. Задължително условие: металът трябва да стои в ECHRNM преди водорода, тъй като металите, стоящи след водорода, не могат да го изместят от състава на киселините. В резултат на реакцията винаги се образува водород под формата на газ и сол. | |
2. С основи. Резултатът от реакцията е сол и вода. Такива реакции на силни киселини с алкали се наричат реакции на неутрализация. | Всяка киселина (силна) + разтворима основа = сол и вода |
| 3. С амфотерни хидроксиди. Долен ред: сол и вода. | 2HNO 2 + берилиев хидроксид \u003d Be (NO 2) 2 (средна сол) + 2H 2 O |
| 4. С основни оксиди. Резултат: вода, сол. | 2HCL + FeO = железен (II) хлорид + H 2 O |
| 5. С амфотерни оксиди. Краен ефект: сол и вода. | 2HI + ZnO = ZnI 2 + H 2 O |
6. Със соли, образувани от по-слаби киселини. Краен ефект: сол и слаба киселина. | 2HBr + MgCO 3 = магнезиев бромид + H 2 O + CO 2 |
При взаимодействие с метали не всички киселини реагират по един и същи начин. Химията (9 клас) в училище включва много повърхностно изучаване на такива реакции, но дори и на това ниво се разглеждат специфичните свойства на концентрираната азотна и сярна киселина при взаимодействие с метали.
Хидроксиди: основи, амфотерни и неразтворими основи
Оксиди, соли, основи, киселини - всички тези класове вещества имат обща химическа природа, което се обяснява със структурата на кристалната решетка, както и взаимното влияние на атомите в състава на молекулите. Въпреки това, ако за оксидите е възможно да се даде много специфична дефиниция, то за киселините и основите е по-трудно да се направи това.
Точно като киселините, според теорията на ED, основите са вещества, които могат да се разлагат във воден разтвор на метални катиони Me n + и аниони на хидроксо групи OH -.
- Разтворим или алкален ( силни основи, променящи се Образувани от метали I, II групи. Пример: KOH, NaOH, LiOH (тоест се вземат предвид елементи само от основните подгрупи);
- Слабо разтворим или неразтворим (средна сила, не променя цвета на индикаторите). Пример: магнезиев хидроксид, желязо (II), (III) и др.
- Молекулярни (слаби основи, във водна среда те обратимо се дисоциират на йони-молекули). Пример: N 2 H 4, амини, амоняк.
- Амфотерни хидроксиди (показват двойни основно-киселинни свойства). Пример: берилий, цинк и т.н.

Всяка представена група се изучава в училищния курс по химия в раздела "Основи". Химията 8-9 клас включва подробно изучаване на алкали и слабо разтворими съединения.
Основните характерни свойства на основите
Всички алкали и слабо разтворими съединения се срещат в природата в твърдо кристално състояние. В същото време техните точки на топене като правило са ниски и слабо разтворимите хидроксиди се разлагат при нагряване. Основният цвят е различен. Ако алкалите са бели, тогава кристалите на слабо разтворими и молекулярни основи могат да бъдат с много различни цветове. Разтворимостта на повечето съединения от този клас може да се види в таблицата, която представя формулите на оксиди, основи, киселини, соли, показва тяхната разтворимост.
Алкалите могат да променят цвета на индикаторите, както следва: фенолфталеин - малинов, метилов оранжев - жълт. Това се осигурява от свободното присъствие на хидроксо групи в разтвора. Ето защо трудноразтворимите основи не дават такава реакция.
Химичните свойства на всяка група бази са различни.
| Химични свойства | ||
| алкали | трудно разтворими основи | Амфотерни хидроксиди |
I. Взаимодействие с KO (общо - сол и вода): 2LiOH + SO 3 = Li 2 SO 4 + вода II. Взаимодействат с киселини (сол и вода): конвенционални реакции на неутрализация (виж киселини) III. Взаимодействат с АО, за да образуват хидроксокомплекс от сол и вода: 2NaOH + Me + n O \u003d Na 2 Me + n O 2 + H 2 O, или Na 2 IV. Взаимодействат с амфотерни хидроксиди, за да образуват хидроксо комплексни соли: Същото като при АО, само без вода V. Взаимодействат с разтворими соли, за да образуват неразтворими хидроксиди и соли: 3CsOH + железен (III) хлорид = Fe(OH) 3 + 3CsCl VI. Взаимодействат с цинк и алуминий във воден разтвор, за да образуват соли и водород: 2RbOH + 2Al + вода = комплекс с хидроксиден йон 2Rb + 3H 2 | I. При нагряване те могат да се разложат: неразтворим хидроксид = оксид + вода II. Реакции с киселини (общо: сол и вода): Fe(OH) 2 + 2HBr = FeBr 2 + вода III. Взаимодействайте с KO: Me + n (OH) n + KO \u003d сол + H 2 O | I. Реагирайте с киселини, за да образувате сол и вода: (II) + 2HBr = CuBr 2 + вода II. Реагира с алкали: резултат - сол и вода (условие: синтез) Zn(OH) 2 + 2CsOH \u003d сол + 2H 2 O III. Те реагират със силни хидроксиди: резултатът е соли, ако реакцията протича във воден разтвор: Cr(OH) 3 + 3RbOH = Rb 3 |
Това са най-химичните свойства, които основите проявяват. Химията на основите е доста проста и се подчинява на общите закони на всички неорганични съединения.
Клас неорганични соли. Класификация, физични свойства
Въз основа на разпоредбите на ED, солите могат да се нарекат неорганични съединения, които се дисоциират във воден разтвор на метални катиони Me + n и аниони на киселинни остатъци An n-. Така че можете да си представите сол. Химията дава повече от едно определение, но това е най-точното.
В същото време, според тяхната химическа природа, всички соли се разделят на:
- Киселинни (съдържащи водороден катион). Пример: NaHSO4.
- Основни (с хидроксо група). Пример: MgOHNO3, FeOHCL2.
- Среден (състои се само от метален катион и киселинен остатък). Пример: NaCL, CaSO 4.
- Двойно (включва два различни метални катиона). Пример: NaAl(SO 4) 3.
- Комплексни (хидроксокомплекси, аквакомплекси и други). Пример: K 2 .
Формулите на солите отразяват тяхната химическа природа, а също така говорят за качествения и количествения състав на молекулата.

Оксидите, солите, основите, киселините имат различна разтворимост, която може да се види в съответната таблица.
Ако говорим за състоянието на агрегация на соли, тогава трябва да забележите тяхната еднородност. Те съществуват само в твърдо, кристално или прахообразно състояние. Цветовата схема е доста разнообразна. Разтворите на комплексни соли, като правило, имат ярки наситени цветове.
Химични взаимодействия за класа на средните соли
Те имат подобни химични свойства на основи, киселини, соли. Оксидите, както вече разгледахме, се различават донякъде от тях по този фактор.
Общо за средните соли могат да се разграничат 4 основни типа взаимодействия.
I. Взаимодействие с киселини (само силни по отношение на ED) с образуването на друга сол и слаба киселина:
KCNS + HCL = KCL + HCNS
II. Реакции с разтворими хидроксиди с появата на соли и неразтворими основи:
CuSO 4 + 2LiOH = 2LiSO 4 разтворима сол + Cu(OH) 2 неразтворима основа
III. Взаимодействие с друга разтворима сол за образуване на неразтворима и разтворима сол:
PbCL 2 + Na 2 S = PbS + 2NaCL
IV. Реакции с метали вляво от този, който образува солта в EHRNM. В този случай металът, който влиза в реакцията, при нормални условия не трябва да взаимодейства с вода:
Mg + 2AgCL = MgCL 2 + 2Ag
Това са основните видове взаимодействия, които са характерни за средните соли. Формулите на сложните, основните, двойните и киселинните соли говорят сами за спецификата на проявените химични свойства.

Формулите на оксиди, основи, киселини, соли отразяват химическата природа на всички представители на тези класове неорганични съединения и освен това дават представа за името на веществото и неговото физични свойства. Ето защо трябва да се обърне специално внимание на тяхното писане. Огромно разнообразие от съединения ни предлага една като цяло невероятна наука - химия. Оксиди, основи, киселини, соли - това е само част от огромното разнообразие.
Оксидинаричат се сложни вещества, съставът на молекулите на които включва кислородни атоми в степен на окисление - 2 и някой друг елемент.
може да се получи чрез директно взаимодействие на кислород с друг елемент или индиректно (например чрез разлагане на соли, основи, киселини). При нормални условия оксидите са в твърдо, течно и газообразно състояние, този тип съединения са много разпространени в природата. оксиди се намират в земната кора. Ръжда, пясък, вода, въглероден двуокисса оксиди.
Биват солеобразуващи и несолеобразуващи.
Солеобразуващи оксиди- Това са оксиди, които образуват соли в резултат на химични реакции. Това са оксиди на метали и неметали, които при взаимодействие с вода образуват съответните киселини, а при взаимодействие с основи - съответните киселинни и нормални соли. Например,медният оксид (CuO) е солеобразуващ оксид, тъй като например, когато реагира със солна киселина (HCl), се образува сол:
CuO + 2HCl → CuCl 2 + H 2 O.
В резултат на химични реакции могат да се получат други соли:
CuO + SO 3 → CuSO 4.
Несолеобразуващи оксидинаречени оксиди, които не образуват соли. Пример е CO, N2O, NO.
Солеобразуващите оксиди от своя страна са 3 вида: основни (от думата «
база »
), кисели и амфотерни.
Основни оксидинаричат се такива метални оксиди, които съответстват на хидроксиди, принадлежащи към класа на основите. Основните оксиди включват, например, Na 2 O, K 2 O, MgO, CaO и др.
 Химични свойства на основните оксиди
Химични свойства на основните оксиди
1. Водоразтворимите основни оксиди реагират с вода, за да образуват основи:
Na 2 O + H 2 O → 2NaOH.
2. Взаимодействат с киселинни оксиди, образувайки съответните соли
Na 2 O + SO 3 → Na 2 SO 4.
3. Реагирайте с киселини, за да образувате сол и вода:
CuO + H 2 SO 4 → CuSO 4 + H 2 O.
4. Реагирайте с амфотерни оксиди:
Li 2 O + Al 2 O 3 → 2LiAlO 2 .
Ако вторият елемент в състава на оксидите е неметал или метал с по-висока валентност (обикновено проявява от IV до VII), тогава такива оксиди ще бъдат киселинни. Киселинните оксиди (киселинни анхидриди) са оксиди, които съответстват на хидроксиди, принадлежащи към класа на киселините. Това е например CO 2, SO 3, P 2 O 5, N 2 O 3, Cl 2 O 5, Mn 2 O 7 и др. Киселинните оксиди се разтварят във вода и алкали, образувайки сол и вода.
Химични свойства на киселинните оксиди
1. Взаимодействат с вода, образувайки киселина:
SO 3 + H 2 O → H 2 SO 4.
Но не всички киселинни оксиди реагират директно с вода (SiO 2 и други).
2. Реагирайте с базирани оксиди, за да образувате сол:
CO 2 + CaO → CaCO 3
3. Взаимодействат с алкали, образувайки сол и вода:
CO 2 + Ba (OH) 2 → BaCO 3 + H 2 O.
Част амфотерен оксидвключва елемент, който има амфотерни свойства. Амфотерността се разбира като способността на съединенията да проявяват киселинни и основни свойства в зависимост от условията.Например, цинковият оксид ZnO може да бъде както основа, така и киселина (Zn(OH) 2 и H 2 ZnO 2). Амфотерността се изразява в това, че в зависимост от условията амфотерните оксиди проявяват основни или киселинни свойства.
Химични свойства на амфотерните оксиди
1. Взаимодействат с киселини, за да образуват сол и вода:
ZnO + 2HCl → ZnCl 2 + H 2 O.
2. Реагирайте с твърди алкали (по време на синтез), образувайки в резултат на реакцията сол - натриев цинкат и вода:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O.
Когато цинковият оксид взаимодейства с алкален разтвор (същия NaOH), възниква друга реакция:
ZnO + 2 NaOH + H 2 O => Na 2.
Координационно число - характеристика, която определя броя на най-близките частици: атоми или йони в молекула или кристал. Всеки амфотерен метал има свое собствено координационно число. За Be и Zn е 4; За и А1 е 4 или 6; За и Cr е 6 или (много рядко) 4;
Амфотерните оксиди обикновено не се разтварят във вода и не реагират с нея.
Имате ли някакви въпроси? Искате ли да знаете повече за оксидите?
За да получите помощта на преподавател - регистрирайте се.
Първият урок е безплатен!
сайт, с пълно или частично копиране на материала, връзката към източника е задължителна.
 Кимване и нек на три или повече числа Как да намерим най-малкото общо кратно на числа
Кимване и нек на три или повече числа Как да намерим най-малкото общо кратно на числа Правила на глаголите и техния правопис
Правила на глаголите и техния правопис Неизвестна WFD или някои примери за използване на моторно-компресорен двигател
Неизвестна WFD или някои примери за използване на моторно-компресорен двигател Предсказанията на Ванга през годините – какво ни очаква в бъдеще?
Предсказанията на Ванга през годините – какво ни очаква в бъдеще? Уравнение на равнина, преминаваща през три точки Вид уравнение на равнина, пресичаща три точки
Уравнение на равнина, преминаваща през три точки Вид уравнение на равнина, пресичаща три точки Как да определим периодичността на функция Функцията се нарича периодична, ако съществува
Как да определим периодичността на функция Функцията се нарича периодична, ако съществува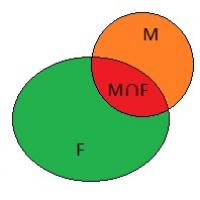 Елементи на теорията на множествата
Елементи на теорията на множествата