Tlenek nie rozpuszcza się w wodzie. Sukcesy współczesnych nauk przyrodniczych. Oddziaływania chemiczne dla klasy soli średnich
Powikłanie budowy substancji w klasyfikacji związków nieorganicznych występuje w następującej kolejności: pierwiastki ® tlenki (zasadowe, kwasowe, amfoteryczne) ® wodorotlenki (zasady i kwasy) ® sole (średnie, kwaśne, zasadowe).
Tlenki Związki składają się z dwóch pierwiastków, z których jednym jest tlen.. Ze względu na charakter chemiczny tlenki dzielą się na trzy grupy:
tlenki zasadowe, Na 2 O, MgO, CaO, FeO, NiO, Fe 2 O 3 , …;
tlenki kwasowe, SO 2, SO 3, CO 2, Mn 2 O 7, P 2 O 5, ...;
tlenki amfoteryczne, Al 2 O 3 , ZnO, BeO, SnO, Cr 2 O 3 , PbO
stałe tlenki K 2 O, Al 2 O 3, P 2 O 5, ...
ciecz: SO 3, N 2 O 4, ...
gazowe: CO 2 , NO 2 , SO 2 ...
Ze względu na rozpuszczalność w wodzie tlenki dzielą się na:
NA rozpuszczalny(SO 2 , CO 2 , K 2 O, Na 2 O, Rb 2 O, CaO)
I nierozpuszczalny :( CuO, FeO, NiO, SiO 2 , Al 2 O 3 , MoO 3 , tlenki amfoteryczne)
1.1.1 Tlenki zasadowe
Głównyzwany tlenki które reagują z kwasami tworząc sól i wodę. Główne tlenki obejmują tlenek potasu K 2 O, tlenek wapnia CaO, tlenek manganu (II) MnO, tlenek miedzi (I) Cu 2 O itp.
Zasadowe tlenki reagują z kwasami, tworząc
sól i woda; MnO + 2HCl Þ MnCl2 + H2O; Fe 2 O 3 + 3H 2 SO 4 \u003d Fe 2 (SO 4) 3 + 3H 2 O.
Tlenki zasadowe oddziałują z tlenkami kwasowymi
tworzenie soli: CaO + CO 2 = CaCO 3; 3Na 2 O + P 2 O 5 \u003d 2 Na 3 PO 4.
2FeO + SiO 2 = Fe 2 SiO 4
Tlenki metali alkalicznych i ziem alkalicznych oddziałują z wodą:
K2O + H2O \u003d 2KOH; CaO + H 2 O + Ca (OH) 2
Tlenki zasadowe można również zdefiniować jako tlenki odpowiadające zasadom. Na przykład tlenek manganu MnO odpowiada wodorotlenkowi Mn(OH) 2 . Głównymi tlenkami są tlenki S-, F- I D-pierwiastki na najniższym stopniu utlenienia i niektóre tlenki P-elementy.
Tlenki kwasowe
Tlenki kwasowe można nazwać tlenki, którym odpowiadają kwasy. Tak więc tlenek siarki (VI) SO 3 odpowiada kwasowi siarkowemu H 2 SO 4, najwyższemu tlenkowi manganu (VII) Mn 2 O 7 - kwasowi manganowemu HMnO 4.
(A). Wspólną właściwością wszystkich tlenków kwasowych jest ich zdolność do interakcji z zasadami, tworząc sól i wodę:
CO 2 + 2 NaOH \u003d Na 2 CO 3 + H 2 O, aby zapisać wzór soli, musisz wiedzieć
Jaki kwas odpowiada temu tlenkowi
N 2 O 5 + Ba(OH) 2 = Ba(NO 3) 2 + H 2 O; SO 3 + Ca (OH) 2 \u003d CaSO 4 + H 2 O
[ HNO3]
(B). Tlenki kwasowe oddziałują z tlenkami zasadowymi, tworząc sole: CaO + CO 2 = CaCO 3 ; 3Na 2 O + P 2 O 5 \u003d 2 Na 3 PO 4.
(V). W odniesieniu do wody tlenki kwasowe mogą być dobrze i słabo rozpuszczalne. Rozpuszczalne tlenki obejmują tlenek węgla (IV) CO2, tlenki siarki itp. Słabo rozpuszczalne tlenki kwasowe obejmują tlenek krzemu SiO2, tlenek molibdenu MoO3 itp. Po rozpuszczeniu w wodzie tworzą się kwasy: CO 2 + H 2 O \u003d H 2 CO 3; SO 3 + H 2 O \u003d H 2 SO 4
31 Moskiewski Państwowy Uniwersytet Techniczny Łomonosowa NE Baumana
2 Pierwszy Moskiewski Państwowy Uniwersytet Medyczny. ICH. Sieczenow
3 Moskiewski Państwowy Uniwersytet Pedagogiczny
Zagadnienia trawienia osadów tlenkowych z powierzchni stali zawierających kobalt i żelazo zawsze miały znaczenie praktyczne i były aktualne. Po przestudiowaniu dużej ilości materiału na ten temat autorzy stwierdzają, że niektóre aspekty problemu nie zostały jeszcze w pełni zbadane (m.in. wpływ charakterystyki roztworów elektrolitów, identyfikacja mechanizmu działania tych czynników). Tlenki kobaltu i żelaza znajdują szerokie zastosowanie jako katalizatory w różnych procesach chemicznych (utlenianie metanu i tlenku węgla, odwodornienie parafin itp.). Ich właściwości zależą od cech powierzchni, które determinują kinetykę rozpuszczania tlenku. Badania eksperymentalne wpływu kwasów mineralnych (w szczególności H2SO4) na szybkość reakcji heterogenicznej (Co3O4 i Fe3O4 w środowisku kwaśnym) ujawniły charakter etapu granicznego, polegającego na tworzeniu się związków powierzchniowych w postaci - i ich późniejsze przejście w roztwór elektrolitu. Opracowano także analizę systemową krzywych rozpuszczania tlenków w celu obliczenia parametrów kinetycznych: energii aktywacji i rzędów reakcji dla jonów wodorowych i jonów siarczanowych.
tlenek kobaltu
tlenek żelaza
kinetyka
rozpuszczenie
modelowanie
Model Bartona – Stransky’ego
Metoda Hougena – Watsona
1. Bokshtein B.S., Mendelev M.I., Pokhvisnev Yu.V. Chemia fizyczna: termodynamika i kinetyka. - M.: Wydawnictwo "MISIS", 2012. - 258 s.
2. Butler J. Równowaga jonowa. - L.: Chemia, 1973. - 448 s.
3. Delmon B. Kinetyka reakcji heterogenicznych. – M.: Mir, 1972. – 555 s.
4. Barre P. Kinetyka procesów heterogenicznych. – M.: Mir, 1976. – 400 s.
5. Kiselev M.Yu. Mechanizm i kinetyka rozpuszczania pirytu metodą elektrochemicznego chlorowania. Magazyn górniczy. - 2010. - nr 4. - S. 101-104.
6. Kortsenshtein N.M., Samuilov E.V. Kondensacja masowa w reakcjach heterogenicznych // Dziennik koloidalny. - 2013. - T. 75, nr 1. - 84 s.
7. Kolesnikov V.A., Kapustin V.A., Kapustin Yu.I., Isaev M.K., Kolesnikov A.V. Tlenki metali – obiecujące materiały dla procesów elektrochemicznych // Szkło i ceramika. - 2016. - nr 12. - s. 23–28.
8. Yakusheva E.A., Gorichev I.G., Atanasyan T.K., Izotov A.D. Badanie kinetyki rozpuszczania tlenków kobaltu (Co3O4, Co2O3) przy różnych stężeniach H2SO4, HCl, EDTA i pH // Wołgograd: Streszczenia XIX Mend. Kongres Generalny i chemia stosowana. - 2011. - T. 3 - S. 366.
9. Yakusheva E.A., Gorichev I.G., Atanasyan T.K., Liner Yu.A. Kinetyka rozpuszczania tlenków kobaltu w środowisku kwaśnym // Metale. - 2010. - nr 2. - s. 21–27.
10. Yakusheva E.A., Gorichev I.G., Atanasyan T.K., Plakhotnaya O.N., Goryacheva V.N. Modelowanie procesów kinetycznych rozpuszczania tlenków kobaltu i miedzi w kwasie siarkowym // Biuletyn MSTU im. NE Baumana. Ser. Nauki przyrodnicze. - 2017. - nr 3. - C. 124–134.
Badania eksperymentalne rozpuszczania faz tlenkowych pozwalają szczegółowo opisać procesy zachowania fazy stałej w środowisku kwaśnym, wyjaśnić zjawiska zachodzące na powierzchni tlenków, biorąc pod uwagę ich charakterystykę kwasowo-zasadową oraz mechanizm rozpuszczania, modelowanie toposu reakcje chemiczne.
Cel badania polega na badaniu i modelowaniu procesu rozpuszczania Co3O4 i Fe3O4 w kwasie siarkowym.
Materiały i metody badań
Do badań pobrano próbki o masie 500 mg i d = 80÷100 µm. Identyfikację tlenków przeprowadzono metodą rentgenowskiej analizy fazowej, IR i analizy termicznej.
W celu wyjaśnienia mechanizmu rozpuszczania próbek stałych tlenków metali w środowisku kwaśnym doświadczenie przeprowadzono w urządzeniu (reaktorze sterowanym termostatycznie o pojemności 0,5 l) w celu zbadania kinetyki rozpuszczania próbek stałych, z wyłączeniem wpływu wszelkie niekontrolowane czynniki wpływające na badane zjawisko. Temperatura doświadczenia wynosiła 363 K. Doświadczenie prowadzono przy różnych wartościach pH i stężeniach kwasów mineralnych.
W pewnych odstępach czasu pobierano próbkę fazy ciekłej z naczynia reakcyjnego za pomocą szklanego filtru Schotta. Stężenie jonów kobaltu oznaczono spektrofotometrycznie (spektrofotometr UV-3100) przy użyciu tiocyjanianu amonu, a żelaza przy użyciu o-fenantroliny.
Uzyskane dane eksperymentalne dotyczące wpływu stężenia kwasu na szybkość rozpuszczania tlenku kobaltu Co3O4 i Fe3O4 przedstawiono na rysunkach. 1 (punkty – dane eksperymentalne, linie – wynik symulacji). Frakcję substancji rozpuszczonej a obliczono za pomocą równania: a = Dt/D∞.

Ryż. 1. a) zależność proporcji rozpuszczonego tlenku Co3O4 od czasu przy różnych stężeniach kwasu siarkowego (mol/l): 1 – 10,0; 2 - 5,93; 3 - 2,97; 4 - 1,0; 5 - 0,57; 6 - 0,12; T = 363,2 K; b) zależność proporcji rozpuszczonego tlenku Fe3O4 od czasu przy różnych stężeniach kwasu siarkowego (mol/l): 1 - 10,3; 2 - 7,82; 3 - 3,86; 4 - 2,44; T = 293 K
Wyniki badań i dyskusja
Obliczanie parametrów kinetycznych. Analizę eksperymentalnych danych kinetycznych przeprowadzono za pomocą równań kinetyki heterogenicznej, co pozwoliło określić rzędy reakcji dla różnych jonów (ni), właściwą szybkość rozpuszczania (Wi), jej zależność od stężenia roztworu oraz energię aktywacji reakcji (Ea).
Kinetyka reakcji heterogenicznych opiera się na obowiązkowym uwzględnieniu zmian powierzchni cząstek w procesie rozpuszczania w czasie, ponadto z reguły reakcje heterogeniczne charakteryzują się stałą szybkością w czasie (1) .
W tym przypadku szybkość rozpuszczania tlenku można przedstawić za pomocą równania:
gdzie Wi jest konkretną szybkością rozpuszczania; f(α) to funkcja uwzględniająca zmiany powierzchni tlenku w czasie.
Aby wyjaśnić mechanizm rozpuszczania i zasymulować to zjawisko, skorzystaliśmy z modelu Bartona – Strańskiego (2):
![]() , (2)
, (2)
gdzie A jest stałą. Jego wartość jest wprost proporcjonalna do liczby aktywnych centrów na powierzchni jednej cząstki tlenku.
Do znalezienia wartości zmiennych W i A wykorzystano metody analizy regresji nieliniowej oraz program komputerowy MathCad.
Tabela 1
Specyficzna szybkość rozpuszczania tlenków Co3O4 i Fe3O4 w zależności od stężenia H2SO4
Z danych tabeli i ryc. 2 (kropki – dane eksperymentalne, linie – wynik modelowania równaniem (3)) wynika, że tlenek kobaltu Co3O4 rozpuszcza się w kwasie siarkowym szybciej niż tlenek żelaza Fe3O4. Rząd reakcji pod względem jonów wodorowych dla dwóch tlenków wynosi w przybliżeniu 0,5. (wszystkie wyniki uzyskano na podstawie modelu Bartona – Strańskiego).


Ryż. 2. a) zależność logarytmu szybkości (log W) od logarytmu stężenia (log C(H2SO4)) rozpuszczania Co3O4 w kwasie siarkowym; b) zależność logarytmu szybkości (log W) od logarytmu stężenia (log C(H2SO4)) rozpuszczania Fe3O4 w kwasie siarkowym
Uzyskane dane pozwalają opisać zależność pomiędzy właściwą szybkością rozpuszczania tlenków Co3O4 i Fe3O4 a stężeniem H2SO4 za pomocą uogólnionego równania
![]() , (3)
, (3)
gdzie ≡, W0 – stała szybkości rozpuszczania, K1, K2 – stałe.
Modelowanie mechanizmu rozpuszczania tlenków kobaltu i żelaza w kwasie nieorganicznym. Rozpuszczanie tlenków w kwasach następuje na defektach powierzchniowych sieci krystalicznej, tzw. aktywnych centrach rozpuszczania tlenków, adsorbujących jony H+ i pary jonowe H+…A-.
Metoda Hougena-Watsona umożliwia symulację wpływu pH i stężenia kwasu na szybkość rozpuszczania tlenków.
W tym przypadku szybkość rozpuszczania tlenków kobaltu i żelaza zostanie wyrażona równaniem:
Prawdopodobnie na powierzchni tlenków tworzą się cząstki hydroksykompleksów metali o takim samym składzie jak w roztworze. Aby obliczyć stężenie hydroksykompleksów, wykorzystaliśmy równania bilansu materiałowego w reakcjach hydrolizy w odniesieniu do jonów wodoru, kobaltu i żelaza; równania hydrolizy dla wszystkich etapów w celu obliczenia stałych hydrolizy. Metoda Hougena-Watsona zakłada, że zależność stężenia jonów na powierzchni tlenków i w roztworze jest zgodna z izotermą Langmuira, która pozwala powiązać stężenia jonów na powierzchni i objętości (równanie (5)).
Zależność specyficznej szybkości rozpuszczania tlenków kobaltu Co3O4 i Fe3O4 w rozcieńczonym kwasie siarkowym wyrażona jest równaniami (5-7).
Stężenie jonów można wyrazić jako sumaryczne stężenie jonów Co3+ i Fe3+, jeżeli zostanie ustalona ich zawartość w roztworze. W tym przypadku i. Wtedy prędkość jest
Jeśli zasymulujemy proces rozpuszczania tlenku i założymy, że jony działają jak cząstki powierzchniowo czynne, to zależność szybkości procesu od stężenia jonów będzie wyglądać następująco (a1 to liczba jonów w roztworze).
zwiększyć
rozpuszczalność tlenków i
wodorotlenki
Podgrupa
Rozpuszczając się, tlenki jonowe wchodzą w interakcję chemiczną z wodą, tworząc odpowiednie wodorotlenki:
Na2O + H2O → 2NaOH
CaO + H 2 O → Ca (OH) 2
bardzo silny
zasadowa zasada tlenkowa
Wodorotlenki metali alkalicznych i ziem alkalicznych są mocnymi zasadami i całkowicie dysocjują w wodzie na kationy metali i jony wodorotlenkowe:
NaOH Na + + OH –
Ze względu na wzrost stężenia jonów OH – roztwory tych substancji charakteryzują się silnie zasadowym środowiskiem (pH>>7); nazywane są alkaliami.
Druga grupa wysoce rozpuszczalny w tlenkach wody i odpowiadających im związkach hydroksylowych - tlenki molekularne i kwasy z kowalencyjnym typem wiązań chemicznych. Należą do nich związki typowych niemetali na najwyższym stopniu utlenienia oraz niektóre d-metale na stopniu utlenienia: +6, +7. Rozpuszczalne tlenki molekularne (SO 3, N 2 O 5, Cl 2 O 7, Mn 2 O 7) oddziałują z wodą, tworząc odpowiednie kwasy:
SO 3 + H 2 O H 2 SO 4
tlenek siarki (VI) kwas siarkowy
mocny kwas, mocny kwas
N 2 O 5 + H 2 O 2HNO 3
tlenek azotu (V) kwas azotowy
Mn 2 O 7 + H 2 O 2HMnO 4
tlenek manganu(VII) kwas manganowy
Silne kwasy (H 2 SO 4, HNO 3, HClO 4, HClO 3, HMnO 4) w roztworach całkowicie dysocjują na kationy H + i reszty kwasowe:
Etap 2: H 2 PO 4 – H + + HPO 4 2–
K. 2 \u003d (= 6,2 ∙ 10 -8;
III etap: HPO 4 2– H + + PO 4 3–
K. 3 \u003d () / \u003d 4,4 ∙ 10 -13,
gdzie K 1 , K 2 , K 3 są stałymi dysocjacji kwasu ortofosforowego odpowiednio w pierwszym, drugim i trzecim etapie.
Stała dysocjacji (tabela 1 w załączniku) charakteryzuje siłę kwasu, tj. jego zdolność do rozkładu (dysocjacji) na jony w środowisku danego rozpuszczalnika w danej temperaturze. Im większa stała dysocjacji, tym bardziej równowaga jest przesunięta w kierunku tworzenia jonów, tym silniejszy jest kwas, tj. w pierwszym etapie dysocjacja kwasu fosforowego przebiega lepiej niż w drugim i odpowiednio w trzecim etapie.
Umiarkowanie rozpuszczalne tlenki siarki (IV), węgla (IV), azotu (III) itp. Tworzą w wodzie odpowiednie słabe kwasy, które częściowo dysocjują.
CO 2 + H 2 O H 2 CO 3 H + + HCO 3 -
SO 2 + H 2 O H 2 SO 3 H + + HSO 3 -
N 2 O 3 + H 2 O 2HNO 2 H + + NO 2 -
słaby-słaby
kwasy kwaśne
Reakcja neutralizacji
Reakcję neutralizacji można wyrazić następującym schematem:
| H2O |
(zasada lub (kwas lub kwas-
tlenek zasadowy) nowy tlenek)
5.3.1. Podstawowe właściwości związków wykazują tlenki i wodorotlenki s-metali (z wyjątkiem Be), d-metali na stopniu utlenienia (+1, +2) (z wyjątkiem Zn) i niektórych p-metali (patrz ryc. 3).
| VIIIA | ||||||||||
| ja A | II A | IIIA | IVA | VA | PRZEZ | VIIA | ||||
| Li |  Być Być | B | C | N | O | F | ||||
Ryż. 3. Właściwości kwasowo-zasadowe tlenków i odpowiadających im związków hydroksylowych
Charakterystyczną właściwością związków zasadowych jest ich zdolność do oddziaływania z kwasami, tlenkami kwasowymi lub amfoterycznymi tworząc sole, na przykład:
KOH + HCl KCl + H2O
Ba(OH) 2 + CO 2 BaCO 3 + H 2 O
2NaO + Al 2 O 3 2NaAlO 2 + H 2 O
W zależności od liczby protonów, które mogą przyłączyć się do zasady, istnieją zasady jednokwasowe (na przykład LiOH, KOH, NH 4OH), zasady dikwasowe itp.
W przypadku zasad polikwasowych reakcja zobojętniania może przebiegać etapami z utworzeniem soli zasadowych, a następnie soli pośrednich.
Me(OH)2 MeOHCl MeCl2
wodorotlenek NaOH zasadowy ośrodek NaOH
sól metalu
Na przykład:
Etap 1: Co(OH) 2 + HCl CoOHCl + H 2 O
hydroksykobalt(II)
(sól podstawowa)
Etap 2: Co(OH)Cl + HCl CoCl 2 + H 2 O
kobalt(II)
5.3.2. Właściwości związków kwasowych wykazują tlenki i kwasy niemetali, a także metali d na stopniu utlenienia (+5, +6, +7) (patrz ryc. 3).
Charakterystyczną właściwością jest ich zdolność do oddziaływania z zasadami, tlenkami zasadowymi i amfoterycznymi tworząc sole, np.:
2HNO 3 + Cu(OH) 2 → Cu(NO 3) 2 + 2H 2 O
2HCl + CaO → CaCl2 + H2O
H 2 SO 4 + ZnO → ZnSO 4 + H 2 O
CrO 3 + 2NaOH → Na 2 CrO 4 + H 2 O
W zależności od obecności tlenu w swoim składzie kwasy dzielą się na zawierający tlen(na przykład H 2 SO 4, HNO 3) i beztlenowy(HBr, H2S). W zależności od liczby atomów wodoru zawartych w cząsteczce kwasu, które można zastąpić atomami metalu, wyróżnia się kwasy jednozasadowe (na przykład chlorowodór HCl, kwas azotawy HNO 2), dwuzasadowe (siarkowy H 2 SO 3, węgiel H 2 CO 3), trójzasadowy (ortofosforowy H 3 PO 4) itp.
Kwasy wielozasadowe neutralizuje się stopniowo, tworząc początkowo kwaśne, a następnie średnie sole:
H2X NaHX Na2X
środowisko kwasu wielozasadowego
sól kwasowa
Na przykład kwas ortofosforowy może tworzyć trzy rodzaje soli, w zależności od stosunku ilościowego kwasu i zasady:
a) NaOH + H3PO4 → NaH2PO4 + H2O;
Diwodorofosforan 1:1
b) 2NaOH + H3PO4 → Na2HPO4 + 2H2O;
Wodorofosforan 2:1
c) 3NaOH + H3PO4 → Na3PO4 + 3H2O.
ortofosforan 3:1
5.3.3. Tlenki i wodorotlenki amfoteryczne tworzą Be, p-metale zlokalizowane w pobliżu „przekątnej amfoterycznej” (Al, Ga, Sn, Pb), a także d-metale na stopniach utlenienia (+3, +4) i Zn (+2) (patrz ryc. 3 ).
Lekko rozpuszczające się wodorotlenki amfoteryczne dysocjują zarówno w formie zasadowej, jak i kwasowej:
2H + + 2– Zn(OH) 2 Zn 2+ + 2OH –
Dlatego amfoteryczne tlenki i wodorotlenki mogą oddziaływać zarówno z kwasami, jak i zasadami. Podczas interakcji z silniejszymi kwasami związki amfoteryczne wykazują właściwości zasad.
ZnO + SO 3 → ZnSO 4 + H 2 O
kwas
Zn(OH) 2 + H 2 SO 4 → ZnSO 4 + H 2 O
kwas zasadowy
znajomości
Podczas interakcji z mocnymi zasadami związki amfoteryczne wykazują właściwości kwasów, tworząc odpowiednie sole. Skład soli zależy od warunków reakcji. Po stopieniu powstają proste „odwodnione” sole.
2NaOH + Zn(OH) 2 → Na 2 ZnO 2 + H 2 O
zasadowy kwas cynkan sodu
mieszanina
2NaOH + ZnO → Na 2 ZnO 2 + H 2 O
W wodnych roztworach zasad powstają sole złożone:
2NaOH + Zn(OH) 2 → Na 2
(wodny tetrahydroksozinian
Współczesna nauka chemiczna to szeroka gama dziedzin, a każda z nich, oprócz podstawy teoretycznej, ma ogromne znaczenie aplikacyjne i praktyczne. Czegokolwiek dotkniesz, wszystko wokół jest produktem produkcji chemicznej. Główne sekcje to chemia nieorganiczna i organiczna. Zastanówmy się, jakie główne klasy substancji zalicza się do nieorganicznych i jakie mają właściwości.
Główne kategorie związków nieorganicznych
Należą do nich:
- Tlenki.
- Sól.
- Podwaliny.
- Kwasy.
Każda z klas jest reprezentowana przez szeroką gamę związków nieorganicznych i jest ważna w niemal każdej strukturze ludzkiej działalności gospodarczej i przemysłowej. Wszystkie główne właściwości charakterystyczne tych związków, występujące w przyrodzie i otrzymywane, są bez wątpienia badane na szkolnym kursie chemii, w klasach 8-11.
Istnieje ogólna tabela tlenków, soli, zasad, kwasów, która przedstawia przykłady każdej z substancji i ich stan skupienia występujący w przyrodzie. Pokazuje także interakcje opisujące właściwości chemiczne. Jednak każdą z klas rozważymy osobno i bardziej szczegółowo.
Grupa związków - tlenki
4. Reakcje, w wyniku których pierwiastki zmieniają CO
Me + n O + C = Me 0 + CO
1. Woda odczynnikowa: powstawanie kwasu (wyjątek SiO2)
KO + woda = kwas
2. Reakcje z zasadami:
CO 2 + 2CsOH \u003d Cs 2 CO 3 + H 2 O
3. Reakcje z tlenkami zasadowymi: tworzenie soli
P 2 O 5 + 3MnO \u003d Mn 3 (PO 3) 2
4. Reakcje OVR:
CO 2 + 2Ca \u003d C + 2CaO,
Wykazują podwójne właściwości, oddziałują na zasadzie metody kwasowo-zasadowej (z kwasami, zasadami, tlenkami zasadowymi, tlenkami kwasowymi). Nie wchodzą w interakcje z wodą.
1. Z kwasami: powstawanie soli i wody
AO + kwas \u003d sól + H2O
2. Z zasadami (zasadami): tworzenie kompleksów hydroksylowych
Al 2 O 3 + LiOH + woda \u003d Li
3. Reakcje z tlenkami kwasowymi: wytwarzanie soli
FeO + SO 2 \u003d FeSO 3
4. Reakcje z RO: tworzenie soli, topienie
MnO + Rb 2 O = sól podwójna Rb 2 MnO 2
5. Reakcje topnienia z alkaliami i węglanami metali alkalicznych: tworzenie soli
Al 2 O 3 + 2LiOH \u003d 2LiAlO 2 + H 2 O
Każdy wyższy tlenek, utworzony zarówno przez metal, jak i niemetal, po rozpuszczeniu w wodzie daje mocny kwas lub zasadę.
Kwasy organiczne i nieorganiczne
W brzmieniu klasycznym (w oparciu o pozycje ED – dysocjacja elektrolityczna – kwasy są związkami, w środowisko wodne dysocjując na kationy H + i aniony reszt kwasowych An - . Jednak obecnie kwasy są dokładnie badane w warunkach bezwodnych, dlatego istnieje wiele różnych teorii dotyczących wodorotlenków.
Wzory empiryczne tlenków, zasad, kwasów, soli składają się wyłącznie z symboli, pierwiastków i wskaźników wskazujących ich ilość w substancji. Na przykład kwasy nieorganiczne wyraża się wzorem H + reszta kwasowa n-. materia organiczna mają inną reprezentację teoretyczną. Oprócz empirycznego można zapisać dla nich pełny i skrócony wzór strukturalny, który będzie odzwierciedlał nie tylko skład i ilość cząsteczki, ale także rozmieszczenie atomów, ich wzajemne relacje i główne grupa funkcyjna kwasów karboksylowych -COOH.
W nieorganicznych wszystkie kwasy są podzielone na dwie grupy:
- beztlenowy – HBr, HCN, HCL i inne;
- zawierające tlen (kwasy okso) - HClO 3 i wszystko, gdzie jest tlen.
Ponadto kwasy nieorganiczne klasyfikuje się według stabilności (stabilne lub stabilne - wszystkie z wyjątkiem węglowych i siarkowych, niestabilne lub niestabilne - węglowe i siarkowe). Siłą kwasy mogą być mocne: siarkowy, solny, azotowy, nadchlorowy i inne, a także słabe: siarkowodór, podchlorawy i inne.

Chemia organiczna w ogóle nie oferuje takiej różnorodności. Kwasy o charakterze organicznym to kwasy karboksylowe. Ich wspólną cechą jest obecność grupy funkcyjnej -COOH. Na przykład HCOOH (antyczny), CH 3 COOH (octowy), C 17 H 35 COOH (stearynowy) i inne.
Istnieje wiele kwasów, które są szczególnie starannie podkreślane podczas rozważania tego tematu na szkolnym kursie chemii.
- Sól.
- Azot.
- Ortofosforowy.
- Bromowodorowy.
- Węgiel.
- Jod.
- Siarkowy.
- Octowy lub etan.
- Butan lub olej.
- Benzoes.
Te 10 kwasów w chemii jest podstawowymi substancjami odpowiedniej klasy zarówno w szkole, jak i ogólnie w przemyśle i syntezie.

Właściwości kwasów nieorganicznych
Główne właściwości fizyczne należy przypisać przede wszystkim odmiennemu stanowi skupienia. Przecież istnieje wiele kwasów, które w normalnych warunkach mają postać kryształów lub proszków (borowy, ortofosforowy). Zdecydowana większość znanych kwasów nieorganicznych to różne ciecze. Temperatury wrzenia i topnienia również się różnią.
Kwasy mogą powodować poważne oparzenia, ponieważ mają zdolność niszczenia tkanek organicznych i skóry. Wskaźniki służą do wykrywania kwasów:
- oranż metylowy (w normalnym środowisku - pomarańczowy, w kwasach - czerwony),
- lakmus (w neutralnym - fioletowy, w kwasach - czerwony) lub inne.
Do najważniejszych właściwości chemicznych należy zdolność do interakcji zarówno z substancjami prostymi, jak i złożonymi.
| Z czym wchodzą w interakcję? | Przykład reakcji |
1. Z prostymi substancjami - metalami. Warunek obowiązkowy: metal musi znajdować się w ECHRNM przed wodorem, ponieważ metale stojące po wodorze nie są w stanie wyprzeć go ze składu kwasów. W wyniku reakcji wodór zawsze powstaje w postaci gazu i soli. | |
2. Z podstawami. Wynikiem reakcji jest sól i woda. Takie reakcje mocnych kwasów z zasadami nazywane są reakcjami zobojętniania. | Dowolny kwas (mocny) + rozpuszczalna zasada = sól i woda |
| 3. Z wodorotlenkami amfoterycznymi. Konkluzja: sól i woda. | 2HNO 2 + wodorotlenek berylu \u003d Be (NO 2) 2 (średnia sól) + 2H 2 O |
| 4. Z tlenkami zasadowymi. Wynik: woda, sól. | 2HCL + FeO = chlorek żelaza (II) + H 2 O |
| 5. Z tlenkami amfoterycznymi. Efekt końcowy: sól i woda. | 2HI + ZnO = ZnI 2 + H 2 O |
6. Z utworzonymi solami słabe kwasy. Efekt końcowy: sól i słaby kwas. | 2HBr + MgCO3 = bromek magnezu + H2O + CO2 |
Podczas interakcji z metalami nie wszystkie kwasy reagują w ten sam sposób. Chemia (klasa 9) w szkole wiąże się z bardzo płytkim badaniem takich reakcji, jednak już na tym poziomie uwzględniane są specyficzne właściwości stężonego kwasu azotowego i siarkowego podczas interakcji z metalami.
Wodorotlenki: zasady, zasady amfoteryczne i nierozpuszczalne
Tlenki, sole, zasady, kwasy - wszystkie te klasy substancji mają wspólną naturę chemiczną, którą tłumaczy się strukturą sieci krystalicznej, a także wzajemnym wpływem atomów na skład cząsteczek. Jeśli jednak w przypadku tlenków można było podać bardzo precyzyjną definicję, to w przypadku kwasów i zasad jest to trudniejsze.
Podobnie jak kwasy, zgodnie z teorią ED, zasady to substancje, które w roztworze wodnym mogą rozkładać się na kationy metali Men + i aniony grup hydroksylowych OH -.
- Rozpuszczalne lub alkaliczne (silne zasady, które się zmieniają. Tworzą metale z grup I, II. Przykład: KOH, NaOH, LiOH (to znaczy brane są pod uwagę pierwiastki tylko z głównych podgrup);
- Słabo rozpuszczalny lub nierozpuszczalny (średnia moc, nie zmienia koloru wskaźników). Przykład: wodorotlenek magnezu, żelazo (II), (III) i inne.
- Molekularne (słabe zasady, w środowisku wodnym odwracalnie dysocjują na cząsteczki jonów). Przykład: N 2 H 4, aminy, amoniak.
- Wodorotlenki amfoteryczne (wykazują podwójne właściwości zasadowo-kwasowe). Przykład: beryl, cynk i tak dalej.

Każda reprezentowana grupa uczy się na szkolnym kursie chemii w dziale „Podstawy”. Klasy z chemii 8-9 obejmują szczegółowe badanie zasad i trudno rozpuszczalnych związków.
Główne charakterystyczne właściwości zasad
Wszystkie zasady i trudno rozpuszczalne związki występują w przyrodzie w stałym stanie krystalicznym. Jednocześnie ich temperatury topnienia są z reguły niskie, a słabo rozpuszczalne wodorotlenki rozkładają się po podgrzaniu. Kolor bazowy jest inny. Jeśli zasady są białe, wówczas kryształy zasad trudno rozpuszczalnych i molekularnych mogą mieć bardzo różne kolory. Rozpuszczalność większości związków tej klasy można zobaczyć w tabeli, która przedstawia wzory tlenków, zasad, kwasów, soli, pokazuje ich rozpuszczalność.
Alkalia potrafią zmieniać barwę wskaźników w następujący sposób: fenoloftaleina – malinowa, oranż metylowy – żółta. Zapewnia to swobodna obecność grup hydroksylowych w roztworze. Dlatego trudno rozpuszczalne zasady nie dają takiej reakcji.
Właściwości chemiczne każdej grupy zasad są różne.
| Właściwości chemiczne | ||
| alkalia | słabo rozpuszczalne zasady | Wodorotlenki amfoteryczne |
I. Interakcja z KO (ogółem - sól i woda): 2LiOH + SO 3 = Li 2 SO 4 + woda II. Interakcja z kwasami (sól i woda): konwencjonalne reakcje neutralizacji (patrz kwasy) III. Wejdź w interakcję z AO, tworząc hydroksykompleks soli i wody: 2NaOH + Me + n O \u003d Na 2 Me + n O 2 + H 2 O lub Na 2 IV. Oddziałują z wodorotlenkami amfoterycznymi, tworząc sole hydroksykompleksowe: To samo co z AO, tylko bez wody V. Oddziałuj z rozpuszczalnymi solami, tworząc nierozpuszczalne wodorotlenki i sole: 3CsOH + chlorek żelaza (III) = Fe(OH) 3 + 3CsCl VI. Oddziałuj z cynkiem i aluminium w roztworze wodnym, tworząc sole i wodór: 2RbOH + 2Al + woda = kompleks z jonem wodorotlenkowym 2Rb + 3H 2 | I. Po podgrzaniu mogą się rozkładać: nierozpuszczalny wodorotlenek = tlenek + woda II. Reakcje z kwasami (ogółem: sól i woda): Fe(OH) 2 + 2HBr = FeBr 2 + woda III. Wejdź w interakcję z KO: Me + n (OH) n + KO \u003d sól + H 2 O | I. Reaguje z kwasami tworząc sól i wodę: (II) + 2HBr = CuBr2 + woda II. Reaguje z zasadami: wynik - sól i woda (stan: stopienie) Zn(OH) 2 + 2CsOH \u003d sól + 2H 2 O III. Reagują z mocnymi wodorotlenkami: powstają sole, jeśli reakcja zachodzi w roztworze wodnym: Cr(OH)3 + 3RbOH = Rb3 |
Są to najbardziej właściwości chemiczne, jakie wykazują zasady. Chemia zasad jest dość prosta i podlega ogólnym prawom wszystkich związków nieorganicznych.
Klasa soli nieorganicznych. Klasyfikacja, właściwości fizyczne
W oparciu o postanowienia ED sole można nazwać związkami nieorganicznymi, które w roztworze wodnym dysocjują na kationy metali Me + n i aniony reszt kwasowych An n-. Więc możesz sobie wyobrazić sól. Chemia podaje więcej niż jedną definicję, ale ta jest najdokładniejsza.
Jednocześnie, zgodnie z ich naturą chemiczną, wszystkie sole dzielą się na:
- Kwaśny (zawierający kation wodoru). Przykład: NaHSO4.
- Podstawowy (posiadający grupę hydroksylową). Przykład: MgOHNO 3 , FeOHCL 2.
- Medium (składa się tylko z kationu metalu i reszty kwasowej). Przykład: NaCL, CaSO4.
- Podwójne (obejmuje dwa różne kationy metali). Przykład: NaAl(SO4) 3.
- Złożone (hydroksokompleksy, akwakompleksy i inne). Przykład: K 2 .
Formuły soli odzwierciedlają ich naturę chemiczną, a także mówią o jakościowym i ilościowym składzie cząsteczki.

Tlenki, sole, zasady, kwasy mają różną rozpuszczalność, co można zobaczyć w odpowiedniej tabeli.
Jeśli mówimy o stanie agregacji soli, należy zwrócić uwagę na ich jednorodność. Występują tylko w stanie stałym, krystalicznym lub sproszkowanym. Kolorystyka jest dość zróżnicowana. Roztwory soli złożonych mają z reguły jasne nasycone kolory.
Oddziaływania chemiczne dla klasy soli średnich
Mają podobne właściwości chemiczne zasad, kwasów, soli. Tlenki, jak już rozważaliśmy, różnią się nieco od nich pod tym względem.
W sumie dla soli średnich można wyróżnić 4 główne typy oddziaływań.
I. Oddziaływanie z kwasami (tylko silnymi pod względem ED) z utworzeniem kolejnej soli i słabego kwasu:
KCNS + HCL = KCL + HCNS
II. Reakcje z rozpuszczalnymi wodorotlenkami z pojawieniem się soli i nierozpuszczalnych zasad:
CuSO 4 + 2LiOH = 2LiSO 4 sól rozpuszczalna + Cu(OH) 2 nierozpuszczalna zasada
III. Interakcja z inną rozpuszczalną solą z wytworzeniem soli nierozpuszczalnej i soli rozpuszczalnej:
PbCL2 + Na2S = PbS + 2NaCL
IV. Reakcje z metalami po lewej stronie tego, który tworzy sól w EHRNM. W takim przypadku metal wchodzący w reakcję nie powinien w normalnych warunkach wchodzić w interakcję z wodą:
Mg + 2AgCL = MgCL2 + 2Ag
Są to główne rodzaje interakcji charakterystyczne dla soli średnich. Formuły soli złożonych, zasadowych, podwójnych i kwasowych mówią same za siebie o specyfice przejawianych właściwości chemicznych.

Wzory tlenków, zasad, kwasów, soli odzwierciedlają naturę chemiczną wszystkich przedstawicieli tych klas związków nieorganicznych, a ponadto dają wyobrażenie o nazwie substancji i jej właściwości fizyczne. Dlatego należy zwrócić szczególną uwagę na ich pisanie. Ogromna różnorodność związków oferuje nam ogólnie niesamowitą naukę - chemię. Tlenki, zasady, kwasy, sole - to tylko część ogromnej różnorodności.
Tlenki nazywane są substancjami złożonymi, których skład cząsteczek obejmuje atomy tlenu na stopniu utlenienia - 2 i jakiś inny pierwiastek.
można otrzymać poprzez bezpośrednie oddziaływanie tlenu z innym pierwiastkiem lub pośrednio (na przykład przez rozkład soli, zasad, kwasów). W normalnych warunkach tlenki występują w stanie stałym, ciekłym i gazowym, tego typu związki są bardzo powszechne w przyrodzie. tlenki znajdują się w skorupa Ziemska. Rdza, piasek, woda, dwutlenek węgla są tlenki.
Są solone i niesolające.
Tlenki tworzące sól- Są to tlenki, które w wyniku reakcji chemicznych tworzą sole. Są to tlenki metali i niemetali, które podczas interakcji z wodą tworzą odpowiednie kwasy, a podczas interakcji z zasadami odpowiednie sole kwasowe i normalne. Na przykład, tlenek miedzi (CuO) jest tlenkiem tworzącym sól, ponieważ np. w reakcji z kwasem solnym (HCl) powstaje sól:
CuO + 2HCl → CuCl2 + H2O.
W wyniku reakcji chemicznych można otrzymać inne sole:
CuO + SO 3 → CuSO 4.
Tlenki nietworzące soli zwane tlenkami, które nie tworzą soli. Przykładem jest CO, N2O, NO.
Z kolei tlenki tworzące sól są 3 rodzajów: podstawowe (od słowa «
baza »
), kwasowy i amfoteryczny.
Zasadowe tlenki nazywane są takie tlenki metali, które odpowiadają wodorotlenkom należącym do klasy zasad. Tlenki zasadowe obejmują na przykład Na2O, K2O, MgO, CaO itp.
 Właściwości chemiczne tlenków zasadowych
Właściwości chemiczne tlenków zasadowych
1. Rozpuszczalne w wodzie zasadowe tlenki reagują z wodą, tworząc zasady:
Na2O + H2O → 2NaOH.
2. Oddziałuj z tlenkami kwasowymi, tworząc odpowiednie sole
Na 2 O + SO 3 → Na 2 SO 4.
3. Reaguj z kwasami tworząc sól i wodę:
CuO + H 2 SO 4 → CuSO 4 + H 2 O.
4. Reaguj z tlenkami amfoterycznymi:
Li 2 O + Al 2 O 3 → 2LiAlO 2 .
Jeśli drugim pierwiastkiem w składzie tlenków jest niemetal lub metal o wyższej wartościowości (zwykle wykazuje od IV do VII), to takie tlenki będą miały odczyn kwasowy. Tlenki kwasowe (bezwodniki kwasowe) to tlenki odpowiadające wodorotlenkom należącym do klasy kwasów. Jest to na przykład CO 2, SO 3, P 2 O 5, N 2 O 3, Cl 2 O 5, Mn 2 O 7 itp. Tlenki kwasowe rozpuszczają się w wodzie i zasadach, tworząc sól i wodę.
Właściwości chemiczne tlenków kwasowych
1. Oddziałuj z wodą, tworząc kwas:
SO 3 + H 2 O → H 2 SO 4.
Ale nie wszystkie tlenki kwasowe bezpośrednio reagują z wodą (SiO2 i inne).
2. Reaguj z tlenkami zasadowymi, tworząc sól:
CO 2 + CaO → CaCO 3
3. Oddziałuj z zasadami, tworząc sól i wodę:
CO 2 + Ba (OH) 2 → BaCO 3 + H 2 O.
Część tlenek amfoteryczny zawiera pierwiastek o właściwościach amfoterycznych. Amfoteryczność rozumiana jest jako zdolność związków do wykazywania właściwości kwasowych i zasadowych w zależności od warunków. Na przykład tlenek cynku ZnO może być zarówno zasadą, jak i kwasem (Zn(OH) 2 i H 2 ZnO 2). Amfoteryczność wyraża się w tym, że w zależności od warunków tlenki amfoteryczne wykazują właściwości zasadowe lub kwasowe.
Właściwości chemiczne tlenków amfoterycznych
1. Oddziałuj z kwasami, tworząc sól i wodę:
ZnO + 2HCl → ZnCl2 + H2O.
2. Reagować z zasadami stałymi (podczas stapiania), tworząc w wyniku reakcji sól - cynkian sodu i wodę:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O.
Kiedy tlenek cynku wchodzi w interakcję z roztworem alkalicznym (tym samym NaOH), zachodzi inna reakcja:
ZnO + 2 NaOH + H 2 O => Na 2.
Liczba koordynacyjna - cecha określająca liczbę najbliższych cząstek: atomów lub jonów w cząsteczce lub krysztale. Każdy metal amfoteryczny ma swój własny numer koordynacyjny. Dla Be i Zn jest to 4; For i Al wynosi 4 lub 6; Dla i Cr jest to 6 lub (bardzo rzadko) 4;
Tlenki amfoteryczne zwykle nie rozpuszczają się w wodzie i nie reagują z nią.
Czy masz jakieś pytania? Chcesz wiedzieć więcej o tlenkach?
Aby skorzystać z pomocy korepetytora - zarejestruj się.
Pierwsza lekcja jest darmowa!
strona, z pełnym lub częściowym kopiowaniem materiału, wymagany jest link do źródła.
 Który czasownik kończy się na e?
Który czasownik kończy się na e? Biografia Tatyana Vizel Podstawy neuropsychologii
Biografia Tatyana Vizel Podstawy neuropsychologii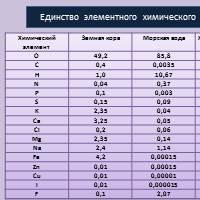 Skład chemiczny komórki
Skład chemiczny komórki Astakhov Pavel Alekseevich, prawnik: biografia, życie osobiste, kariera
Astakhov Pavel Alekseevich, prawnik: biografia, życie osobiste, kariera Krótka informacja o soborach ekumenicznych
Krótka informacja o soborach ekumenicznych Kościół św. Mikołaja Cudotwórcy na Berseniewce
Kościół św. Mikołaja Cudotwórcy na Berseniewce Kto wynalazł rosyjski alfabet?
Kto wynalazł rosyjski alfabet?