Oxidul nu se dizolvă în apă. Succesele științelor naturale moderne. Interacțiuni chimice pentru clasa sărurilor medii
Complicația structurii unei substanțe în clasificarea compușilor anorganici are loc în următoarea succesiune: elemente ® oxizi (bazici, acizi, amfoteri) ® hidroxizi (baze și acizi) ® săruri (medii, acide, bazice).
Oxizi Compușii sunt formați din două elemente, dintre care unul este oxigenul.. După natura chimică, oxizii sunt împărțiți în trei grupe:
oxizi bazici, Na2O, MgO, CaO, FeO, NiO, Fe2O3, …;
oxizi acizi, S02, S03, CO2, Mn2O7, P2O5, ...;
oxizi amfoteri, Al 2 O 3 , ZnO, BeO, SnO, Cr 2 O 3 , PbO
oxizi solizi K 2 O, Al 2 O 3, P 2 O 5, ...
lichid: SO 3, N 2 O 4, ...
gazos: CO 2 , NO 2 , SO 2 ...
În funcție de solubilitatea lor în apă, oxizii sunt împărțiți în:
pe solubil(SO2, CO2, K2O, Na2O, Rb2O, CaO)
Și insolubil :( CuO, FeO, NiO, SiO2, Al2O3, MoO3, oxizi amfoteri)
1.1.1 Oxizi bazici
Principalulnumit oxizi care reacţionează cu acizii formând sare şi apă. Principalii oxizi includ oxid de potasiu K 2 O, oxid de calciu CaO, oxid de mangan (II) MnO, oxid de cupru (I) Cu 2 O etc.
Oxizii bazici reacţionează cu acizii pentru a se forma
sare și apă; MnO + 2HCI Þ MnCI2 + H20; Fe 2 O 3 + 3H 2 SO 4 \u003d Fe 2 (SO 4) 3 + 3H 2 O.
Oxizii bazici interacţionează cu oxizii acizi cu
formarea sărurilor: CaO + CO2 = CaCO3; 3Na 2 O + P 2 O 5 \u003d 2Na 3 PO 4.
2FeO + SiO2 = Fe2SiO4
Oxizii metalelor alcaline și alcalino-pământoase interacționează cu apa:
K 2 O + H 2 O \u003d 2KOH; CaO + H2O + Ca (OH)2
De asemenea, se pot defini oxizii bazici ca acei oxizi care corespund bazelor. De exemplu, oxidul de mangan MnO corespunde hidroxidului Mn(OH)2. Principalii oxizi sunt oxizii s-, f-Și d-elemente în cea mai scăzută stare de oxidare și oxizi ai unora p-elemente.
Oxizii acizi
Oxizii acizi se pot numi oxizii cărora le corespund acizii. Deci, oxidului de sulf (VI) SO 3 corespunde acidului sulfuric H 2 SO 4, cel mai mare oxid de mangan (VII) Mn 2 O 7 - acid mangan HMnO 4.
(A). O proprietate comună a tuturor oxizilor acizi este capacitatea lor de a interacționa cu bazele pentru a forma sare și apă:
CO 2 + 2NaOH \u003d Na 2 CO 3 + H 2 O pentru a scrie formula sării, trebuie să știți
Ce acid îi corespunde acestui oxid
N2O5 + Ba(OH)2 = Ba(N03)2 + H20; SO 3 + Ca (OH) 2 \u003d CaSO 4 + H 2 O
[ HNO3]
(b). Oxizii acizi interacționează cu oxizii bazici pentru a forma săruri: CaO + CO 2 = CaCO 3 ; 3Na 2 O + P 2 O 5 \u003d 2Na 3 PO 4.
(V). În raport cu apa, oxizii acizi pot fi bine și slab solubili. Oxizii solubili includ monoxid de carbon (IV) CO 2 , oxizi de sulf etc. Oxizii acizi slab solubili includ oxid de siliciu SiO 2 , oxid de molibden MoO 3 etc. Când se dizolvă în apă, se formează acizi: CO 2 + H 2 O \u003d H 2 CO 3; SO 3 + H 2 O \u003d H 2 SO 4
31 Universitatea Tehnică de Stat din Moscova Lomonosov N.E. Bauman
2 Prima Universitate Medicală de Stat din Moscova. LOR. Sechenov
3 Universitatea Pedagogică de Stat din Moscova
Problemele de gravare a depozitelor de oxid de pe suprafața oțelurilor care conțin cobalt și fier au fost întotdeauna de importanță practică și au fost relevante. După ce au studiat o cantitate mare de material pe această problemă, autorii afirmă că unele aspecte ale problemei nu au fost încă studiate pe deplin (acestea includ influența caracteristicilor soluțiilor de electroliți, identificarea mecanismului de acțiune al acestor factori). Cobaltul și oxizii de fier sunt folosiți pe scară largă ca catalizatori pentru diferite procese chimice (oxidarea metanului și a monoxidului de carbon, dehidrogenarea parafinelor etc.). Proprietățile lor depind de caracteristicile suprafeței, ceea ce determină cinetica dizolvării oxidului. Studiile experimentale privind efectul acizilor minerali (în special, H2SO4) asupra vitezei unei reacții eterogene (Co3O4 și Fe3O4 în mediu acid) au relevat natura etapei limitative, care constă în formarea compușilor de suprafață de forma - și trecerea lor ulterioară într-o soluție de electrolit. De asemenea, a fost dezvoltată o analiză de sistem a curbelor de dizolvare a oxidului pentru a calcula parametrii cinetici: energia de activare și ordinele de reacție pentru ionii de hidrogen și ionii de sulfat.
oxid de cobalt
oxid de fier
cinetica
dizolvare
modelare
Modelul Barton-Stransky
Metoda Hougen-Watson
1. Bokshtein B.S., Mendelev M.I., Pokhvisnev Yu.V. Chimie fizică: termodinamică și cinetică. - M.: Editura „MISIS”, 2012. - 258 p.
2. Butler J. Echilibrul ionic. - L.: Chimie, 1973. - 448 p.
3. Delmon B. Cinetica reacțiilor eterogene. – M.: Mir, 1972. – 555 p.
4. Barre P. Cinetica proceselor eterogene. – M.: Mir, 1976. – 400 p.
5. Kiselev M.Yu. Mecanismul și cinetica dizolvării piritei prin metoda clorării electrochimice. Revista de minerit. - 2010. - Nr. 4. - S. 101-104.
6. Kortsenshtein N.M., Samuilov E.V. Condensarea în vrac în reacții eterogene // Jurnal coloid. - 2013. - T. 75, nr. 1. - 84 str.
7. Kolesnikov V.A., Kapustin V.A., Kapustin Yu.I., Isaev M.K., Kolesnikov A.V. Oxizi metalici – materiale promițătoare pentru procesele electrochimice // Sticlă și ceramică. - 2016. - Nr. 12. - P. 23–28.
8. Yakusheva E.A., Gorichev I.G., Atanasyan T.K., Izotov A.D. Studiul cineticii de dizolvare a oxizilor de cobalt (Co3O4, Co2O3) la diferite concentrații de H2SO4, HCl, EDTA și pH // Volgograd: Rezumate XIX Mend. congres asupra generală şi chimie aplicată. - 2011. - T. 3 - S. 366.
9. Yakusheva E.A., Gorichev I.G., Atanasyan T.K., Liner Yu.A. Cinetica dizolvării oxizilor de cobalt în medii acide // Metale. - 2010. - Nr. 2. - P. 21–27.
10. Yakusheva E.A., Gorichev I.G., Atanasyan T.K., Plakhotnaya O.N., Goryacheva V.N. Modelarea proceselor cinetice de dizolvare a oxizilor de cobalt si cupru in acid sulfuric // Buletinul MSTU im. N.E. Bauman. Ser. Stiintele Naturii. - 2017. - Nr 3. - C. 124–134.
Studiile experimentale ale dizolvării fazelor de oxizi permit descrierea în detaliu a proceselor de comportare a unei faze solide în mediu acid, explicarea fenomenelor care apar la suprafața oxizilor, ținând cont de caracteristicile lor acido-bazice și mecanismul dizolvării, a modela topo reacții chimice.
Scopul studiului consta in studierea si modelarea procesului de dizolvare a Co3O4 si Fe3O4 in acid sulfuric.
Materiale și metode de cercetare
Pentru cercetare s-au prelevat probe cu o greutate de 500 mg cu d = 80÷100 µm. Identificarea oxizilor a fost efectuată prin fază de raze X, IR și analiză termică.
Pentru a elucida mecanismul de dizolvare a probelor solide de oxizi metalici în medii acide, experimentul a fost efectuat într-un dispozitiv (un reactor controlat termostatic cu un volum de 0,5 l) pentru a studia cinetica de dizolvare a probelor solide, excluzând influența orice factori necontrolați asupra fenomenului studiat. Temperatura experimentului a fost de 363 K. Experimentul a fost efectuat la diferite valori ale pH-ului și concentrații de acid mineral.
La anumite intervale, faza lichidă a fost prelevată din vasul de reacție cu un filtru de sticlă Schott. Concentrația ionilor de cobalt a fost determinată spectrofotometric (spectrofotometru UV-3100) folosind tiocianat de amoniu și fier - folosind o-fenantrolină.
Datele experimentale obținute privind efectul concentrației de acid asupra vitezei de dizolvare a oxidului de cobalt Co3O4 și Fe3O4 sunt prezentate în Fig. 1 (puncte - date experimentale, linii - rezultat simulare). Fracția de solut a a fost calculată folosind ecuația: a = Dt/D∞.

Orez. 1. a) dependenţa proporţiei de oxid dizolvat Co3O4 de timp la diferite concentraţii de acid sulfuric (mol/l): 1 - 10,0; 2 - 5,93; 3 - 2,97; 4 - 1,0; 5 - 0,57; 6 - 0,12; T = 363,2 K; b) dependenţa proporţiei de oxid dizolvat Fe3O4 de timp la diferite concentraţii de acid sulfuric (mol/l): 1 - 10,3; 2 - 7,82; 3 - 3,86; 4 - 2,44; T = 293 K
Rezultatele cercetării și discuții
Calculul parametrilor cinetici. O analiză a datelor cinetice experimentale a fost efectuată folosind ecuațiile cineticii eterogene, ceea ce a făcut posibilă determinarea ordinelor reacțiilor pentru diverși ioni (ni), viteza de dizolvare specifică (Wi), dependența acesteia de concentrația soluției. , și energia de activare a reacțiilor (Ea).
Cinetica reacțiilor eterogene se bazează pe luarea în considerare obligatorie a modificărilor suprafeței particulelor în procesul de dizolvare în timp, în plus, de regulă, reacțiile eterogene sunt caracterizate printr-o viteză constantă în timp (1) .
În acest caz, viteza de dizolvare a oxidului poate fi reprezentată prin ecuația:
unde Wi este viteza de dizolvare specifică; f(α) este o funcție care ia în considerare modul în care suprafața oxidului se modifică în timp.
Pentru a elucida mecanismul de dizolvare și a simula acest fenomen, am luat modelul Barton - Stranski (2):
![]() , (2)
, (2)
unde A este o constantă. Valoarea sa este direct proporțională cu numărul de centre activi de pe suprafața unei particule de oxid.
Pentru a afla valorile variabilelor W și A s-au folosit metodele de analiză a regresiei neliniare și programul de calculator MathCad.
tabelul 1
Viteza de dizolvare specifică a oxizilor de Co3O4 și Fe3O4 în funcție de concentrația de H2SO4
Din datele tabelului și fig. 2 (puncte - date experimentale, linii - rezultatul modelării prin ecuația (3)) rezultă că oxidul de cobalt Co3O4 se dizolvă mai repede în acid sulfuric decât oxidul de fier Fe3O4. Ordinea de reacție în termeni de ioni de hidrogen pentru cei doi oxizi este de aproximativ 0,5. (toate rezultatele sunt obținute pe baza modelului Barton - Stranski).


Orez. 2. a) dependenţa logaritmului vitezei (log W) de logaritmul concentraţiei (log C(H2SO4)) în dizolvarea Co3O4 în acid sulfuric; b) dependența logaritmului ratei (log W) de logaritmul concentrației (log C(H2SO4)) în dizolvarea Fe3O4 în acid sulfuric
Datele obținute fac posibilă descrierea relației dintre viteza de dizolvare specifică a oxizilor de Co3O4 și Fe3O4 și concentrația de H2SO4 prin ecuația generalizată
![]() , (3)
, (3)
unde ≡, W0 - constanta vitezei de dizolvare, K1, K2 - constante.
Modelarea mecanismului de dizolvare a oxizilor de cobalt si fier in acid anorganic. Dizolvarea oxizilor în acizi are loc pe defectele de suprafață ale rețelei cristaline, așa-numiții centri activi de dizolvare a oxizilor, adsorbând ioni H+ și perechile de ioni H+…A-.
Metoda Hougen-Watson face posibilă simularea efectului pH-ului și concentrației de acid asupra vitezei de dizolvare a oxizilor.
În acest caz, viteza de dizolvare a oxizilor de cobalt și fier va fi exprimată prin ecuația:
Probabil, pe suprafața oxizilor se formează particule de hidroxocomplexuri metalice cu aceeași compoziție ca cele aflate în soluție. Pentru a calcula concentrația hidroxocomplexelor, am folosit ecuațiile de bilanț al materialelor în reacțiile de hidroliză în raport cu ionii de hidrogen, cobalt și fier; ecuații de hidroliză pentru toate etapele de calcul al constantelor de hidroliză. Metoda Hougen-Watson presupune că dependența concentrației ionilor de suprafața oxizilor și în soluție se supune izotermei Langmuir, ceea ce face posibilă relaționarea concentrațiilor de suprafață și volum ale ionilor (ecuația (5)).
Dependența vitezei specifice de dizolvare a oxizilor de cobalt Co3O4 și Fe3O4 în acidul sulfuric diluat este exprimată prin ecuațiile (5-7).
Concentrația ionilor și poate fi exprimată prin concentrația totală de ioni de Co3+ și Fe3+, dacă se stabilește conținutul acestora în soluție. În acest caz și . Atunci viteza este
Dacă simulăm procesul de dizolvare a oxidului și presupunem că ionii și acționează ca particule active de suprafață, atunci dependența ratei procesului de concentrația ionilor va arăta astfel (a1 este numărul de ioni din soluție).
crește
solubilitatea oxizilor şi
hidroxizi
Subgrup
În dizolvare, oxizii ionici intră în interacțiune chimică cu apa, formând hidroxizii corespunzători:
Na2O + H2O → 2NaOH
CaO + H2O → Ca (OH)2
foarte puternic
bază de oxid de bază
Hidroxizii metalelor alcaline și alcalino-pământoase sunt baze puternice și se disociază complet în apă în cationi metalici și ioni de hidroxid:
NaOH Na + + OH –
Deoarece concentrația ionilor OH - crește, soluțiile acestor substanțe au un mediu puternic alcalin (pH>>7); se numesc alcaline.
A doua grupă foarte solubilîn oxizi de apă și compuși hidroxi corespunzători acestora - oxizi moleculari și acizi cu legături chimice de tip covalent. Acestea includ compuși ai nemetalelor tipice în cea mai mare stare de oxidare și unele d-metale în stare de oxidare: +6, +7. Oxizii moleculari solubili (SO 3, N 2 O 5, Cl 2 O 7, Mn 2 O 7) interacționează cu apa pentru a forma acizii corespunzători:
SO3 + H20H2SO4
oxid de sulf (VI) acid sulfuric
acid tare acid tare
N2O5 + H202HNO3
oxid nitric (V) acid azotic
Mn2O7 + H2O2HMn04
oxid de mangan (VII) acid mangan
Acizii puternici (H 2 SO 4, HNO 3, HClO 4, HClO 3, HMnO 4) în soluții se disociază complet în cationi H + și reziduuri acide:
Etapa 2: H 2 PO 4 – H + + HPO 4 2–
K 2 \u003d (= 6,2 ∙ 10 -8;
Etapa a 3-a: HPO 4 2– H + + PO 4 3–
K 3 \u003d () / \u003d 4,4 ∙ 10 -13,
unde K 1 , K 2 , K 3 sunt constantele de disociere ale acidului ortofosforic în prima, a doua şi, respectiv, a treia etapă.
Constanta de disociere (Tabelul 1 din apendice) caracterizează puterea acidului, adică. capacitatea sa de a se descompune (disocia) în ioni în mediul unui solvent dat la o temperatură dată. Cu cât constanta de disociere este mai mare, cu atât echilibrul este deplasat spre formarea de ioni, cu atât acidul este mai puternic, de exemplu. în prima etapă, disocierea acidului fosforic merge mai bine decât în a doua și, în consecință, în a treia etapă.
Oxizii moderat solubili de sulf (IV), carbon (IV), azot (III) etc. formează acizii slabi corespunzători în apă, care se disociază parțial.
CO 2 + H 2 O H 2 CO 3 H + + HCO 3 -
SO 2 + H 2 O H 2 SO 3 H + + HSO 3 -
N 2 O 3 + H 2 O 2 HNO 2 H + + NO 2 -
slab-slab
acizi acizi
Reacția de neutralizare
Reacția de neutralizare poate fi exprimată prin următoarea schemă:
| H2O |
(bază sau (acid sau acid-
oxid bazic) oxid de ny)
5.3.1. Proprietăți de bază ale compusului prezintă oxizi și hidroxizi de metale s (cu excepția Be), metale d în stare de oxidare (+1, +2) (cu excepția Zn) și unele metale p (vezi Fig. 3).
| VIIIA | ||||||||||
| IN ABSENTA | II A | IIIA | IVA | VA | PRIN INTERMEDIUL | VIIA | ||||
| Li |  Fi Fi | B | C | N | O | F | ||||
Orez. 3. Proprietățile acido-bazice ale oxizilor și compușilor hidroxi corespunzători acestora
O proprietate caracteristică a compușilor bazici este capacitatea lor de a interacționa cu acizi, oxizi acizi sau amfoteri pentru a forma săruri, de exemplu:
KOH + HCI KCI + H2O
Ba(OH)2 + CO2BaC03 + H2O
2NaO + Al2O32NaAlO2 + H2O
În funcție de numărul de protoni care se pot atașa de bază, există baze simple acide (de exemplu, LiOH, KOH, NH 4 OH), baze diacide etc.
Pentru bazele poliacide, reacția de neutralizare poate decurge în etape cu formarea mai întâi a sărurilor bazice și apoi intermediare.
Me(OH)2MeOHCI MeCI2
hidroxid NaOH mediu NaOH bazic
sare metalică
De exemplu:
Etapa 1: Co(OH)2 + HCI CoOHCI + H2O
hidroxocobalt (II)
(sare de bază)
Etapa 2: Co(OH)CI + HCI CoCl2 + H2O
cobalt (II)
5.3.2. Proprietățile compușilor acizi prezintă oxizi și acizi ai nemetalelor, precum și d-metale în stare de oxidare (+5, +6, +7) (vezi Fig. 3).
O proprietate caracteristică este capacitatea lor de a interacționa cu baze, oxizi bazici și amfoteri pentru a forma săruri, de exemplu:
2HNO 3 + Cu(OH) 2 → Cu(NO 3) 2 + 2H 2 O
2HCl + CaO → CaCl2 + H2O
H2SO4 + ZnO → ZnSO4 + H2O
CrO3 + 2NaOH → Na2CrO4 + H2O
În funcție de prezența oxigenului în compoziția lor, acizii sunt împărțiți în conţinând oxigen(de exemplu, H2S04, HNO3) şi anoxic(HBr, H2S). După numărul de atomi de hidrogen conținuți în molecula acidă care pot fi înlocuite cu atomi de metal, se disting acizii monobazici (de exemplu, acid clorhidric HCl, acid azotat HNO 2), dibazici (H 2 SO 3 sulfuros, cărbune H 2 CO 3), tribazic (H 3 PO 4 ortofosforic) etc.
Acizii polibazici sunt neutralizați treptat cu formarea de săruri inițial acide și apoi medii:
H2X NaHX Na2X
mediu de acid polibazic
sare acidă sare
De exemplu, acidul ortofosforic poate forma trei tipuri de săruri, în funcție de raportul cantitativ dintre acid și alcali luate:
a) NaOH + H3P04 → NaH2PO4 + H20;
fosfat dihidrogen 1:1
b) 2NaOH + H3P04 → Na2HP04 + 2H20;
2:1 hidrogen fosfat
c) 3NaOH + H3PO4 → Na3PO4 + 3H2O.
ortofosfat 3:1
5.3.3. Oxizi și hidroxizi amfoteri forma Be, p-metale situate lângă „diagonala amfoteră” (Al, Ga, Sn, Pb), precum și d-metale în stări de oxidare (+3, +4) și Zn (+2) (vezi Fig. 3). ).
Hidroxizii amfoteri ușor dizolvați se disociază atât în tipuri bazice, cât și în acide:
2H + + 2– Zn(OH) 2 Zn 2+ + 2OH –
Prin urmare, oxizii și hidroxizii amfoteri pot interacționa atât cu acizii, cât și cu bazele. Când interacționează cu acizi mai puternici, compușii amfoteri prezintă proprietățile bazelor.
ZnO + SO3 → ZnSO4 + H2O
acid
Zn(OH)2 + H2SO4 → ZnS04 + H2O
acid bazic
conexiuni
Atunci când interacționează cu baze puternice, compușii amfoteri prezintă proprietățile acizilor, formând sărurile corespunzătoare. Compoziția sării depinde de condițiile de reacție. La topire, se formează săruri simple „deshidratate”.
2NaOH + Zn(OH)2 → Na2ZnO2 + H2O
zincat de sodiu acid de bază
compus
2NaOH + ZnO → Na2ZnO2 + H2O
În soluțiile apoase de alcaline se formează săruri complexe:
2NaOH + Zn(OH)2 → Na2
(tetrahidroxozincat apos
Știința chimică modernă este o mare varietate de ramuri și fiecare dintre ele, pe lângă baza teoretică, are o mare importanță aplicată și practică. Orice ați atinge, totul în jur sunt produse ale producției chimice. Secțiunile principale sunt chimia anorganică și chimia organică. Să luăm în considerare ce clase principale de substanțe sunt clasificate ca anorganice și ce proprietăți au acestea.
Principalele categorii de compuși anorganici
Acestea includ următoarele:
- Oxizi.
- Sare.
- Fundații.
- Acizi.
Fiecare dintre clase este reprezentată de o mare varietate de compuși anorganici și este importantă în aproape orice structură a activității economice și industriale umane. Toate proprietățile principale caracteristice acestor compuși, fiind în natură și obținându-se sunt studiate la cursul școlar de chimie fără greșeală, în clasele 8-11.
Exista un tabel general de oxizi, saruri, baze, acizi, care prezinta exemple ale fiecaruia dintre substante si starea lor de agregare, fiind in natura. De asemenea, arată interacțiuni care descriu proprietăți chimice. Cu toate acestea, vom lua în considerare fiecare dintre clase separat și mai detaliat.
Grup de compuși - oxizi
4. Reacții, în urma cărora elementele modifică CO
Me + n O + C = Me 0 + CO
1. Apă reactivă: formare de acid (excepție SiO 2)
KO + apă = acid
2. Reacții cu baze:
CO 2 + 2CsOH \u003d Cs 2 CO 3 + H 2 O
3. Reacții cu oxizi bazici: formare de sare
P 2 O 5 + 3MnO \u003d Mn 3 (PO 3) 2
4. Reacții OVR:
CO 2 + 2Ca \u003d C + 2CaO,
Ele prezintă proprietăți duale, interacționează după principiul metodei acido-bazice (cu acizi, alcalii, oxizi bazici, oxizi acizi). Nu interacționează cu apa.
1. Cu acizi: formare de săruri și apă
AO + acid \u003d sare + H2O
2. Cu baze (alcaline): formarea de complexe hidroxo
Al 2 O 3 + LiOH + apă \u003d Li
3. Reacții cu oxizi acizi: prepararea sărurilor
FeO + SO 2 \u003d FeSO 3
4. Reacții cu RO: formare de săruri, fuziune
MnO + Rb 2 O = sare dublă Rb 2 MnO 2
5. Reacții de fuziune cu alcalii și carbonați de metale alcaline: formarea sărurilor
Al 2 O 3 + 2LiOH \u003d 2LiAlO 2 + H 2 O
Fiecare oxid superior, format atât dintr-un metal, cât și dintr-un nemetal, atunci când este dizolvat în apă, dă un acid sau alcali puternic.
Acizi organici si anorganici
În sunetul clasic (pe baza pozițiilor ED - disociere electrolitică - acizii sunt compuși, în mediu acvatic disociind în cationi H + şi anioni ai reziduurilor acide An - . Astăzi, totuși, acizii au fost studiați cu atenție în condiții anhidre, așa că există multe teorii diferite pentru hidroxizi.
Formulele empirice ale oxizilor, bazelor, acizilor, sărurilor sunt alcătuite numai din simboluri, elemente și indici care indică cantitatea lor într-o substanță. De exemplu, acizii anorganici sunt exprimați prin formula H + rest acid n-. materie organică au o reprezentare teoretică diferită. În plus față de cea empirică, este posibil să scrieți o formulă structurală completă și prescurtată pentru ele, care va reflecta nu numai compoziția și cantitatea moleculei, ci și aranjarea atomilor, relația lor între ei și principalul grupa functionala pentru acizi carboxilici -COOH.
În cele anorganice, toți acizii sunt împărțiți în două grupe:
- anoxic - HBr, HCN, HCL și altele;
- conţinând oxigen (oxoacizi) - HClO 3 şi tot ceea ce este oxigen.
De asemenea, acizii anorganici sunt clasificați după stabilitate (stabili sau stabili - totul cu excepția carbonici și sulfuri, instabili sau instabili - carbonici și sulfurosi). După putere, acizii pot fi puternici: sulfuric, clorhidric, nitric, percloric și alții, precum și slabi: hidrogen sulfurat, hipocloroși și altele.

Chimia organică nu oferă deloc o asemenea diversitate. Acizii care sunt de natură organică sunt acizi carboxilici. Caracteristica lor comună este prezența unei grupe funcționale -COOH. De exemplu, HCOOH (antic), CH 3 COOH (acetic), C 17 H 35 COOH (stearic) și altele.
Există o serie de acizi, care sunt subliniați cu atenție atunci când luați în considerare acest subiect într-un curs de chimie școlar.
- Sare.
- Azot.
- Ortofosforic.
- Bromhidric.
- Cărbune.
- Iod.
- Sulfuric.
- Acetic sau etan.
- Butan sau ulei.
- Benzoic.
Acești 10 acizi din chimie sunt substanțele fundamentale ale clasei corespunzătoare atât la cursul școlar, cât și în general în industrie și sinteză.

Proprietățile acizilor anorganici
Principalele proprietăți fizice ar trebui atribuite în primul rând unei stări diferite de agregare. La urma urmei, există o serie de acizi care au formă de cristale sau pulberi (boric, ortofosforic) în condiții normale. Marea majoritate a acizilor anorganici cunoscuți sunt lichide diferite. Punctele de fierbere și de topire variază, de asemenea.
Acizii pot provoca arsuri grave, deoarece au puterea de a distruge tesuturile organice si pielea. Indicatorii sunt utilizați pentru a detecta acizi:
- metil portocală (în mediu normal - portocaliu, în acizi - roșu),
- turnesol (în neutru - violet, în acizi - roșu) sau altele.
Cele mai importante proprietăți chimice includ capacitatea de a interacționa atât cu substanțe simple, cât și cu cele complexe.
| Cu ce interacționează ei? | Exemplu de reacție |
1. Cu substante simple-metale. Condiție obligatorie: metalul trebuie să stea în CEHRNM înainte de hidrogen, deoarece metalele care stau după hidrogen nu sunt capabile să-l înlocuiască din compoziția acizilor. Ca rezultat al reacției, hidrogenul se formează întotdeauna sub formă de gaz și sare. | |
2. Cu baze. Rezultatul reacției este sare și apă. Astfel de reacții ale acizilor puternici cu alcalii se numesc reacții de neutralizare. | Orice acid (puternic) + bază solubilă = sare și apă |
| 3. Cu hidroxizi amfoteri. Concluzia: sare și apă. | 2HNO 2 + hidroxid de beriliu \u003d Fi (NO 2) 2 (sare medie) + 2H 2 O |
| 4. Cu oxizi bazici. Rezultat: apă, sare. | 2HCL + FeO = clorură de fier (II) + H2O |
| 5. Cu oxizi amfoteri. Efectul final: sare si apa. | 2HI + ZnO = ZnI2 + H2O |
6. Cu sărurile formate peste acizi slabi. Efect final: sare și acid slab. | 2HBr + MgC03 = bromură de magneziu + H2O + CO2 |
Când interacționează cu metalele, nu toți acizii reacționează în același mod. Chimia (clasa 9) la școală implică un studiu foarte superficial al unor astfel de reacții, cu toate acestea, chiar și la acest nivel, sunt luate în considerare proprietățile specifice ale acidului azotic și sulfuric concentrat atunci când interacționează cu metalele.
Hidroxizi: baze alcaline, baze amfotere și insolubile
Oxizi, săruri, baze, acizi - toate aceste clase de substanțe au o natură chimică comună, care se explică prin structura rețelei cristaline, precum și prin influența reciprocă a atomilor în compoziția moleculelor. Cu toate acestea, dacă pentru oxizi a fost posibil să se dea o definiție foarte specifică, atunci pentru acizi și baze este mai dificil să se facă acest lucru.
La fel ca acizii, conform teoriei ED, bazele sunt substanțe care se pot descompune într-o soluție apoasă în cationi metalici Me n + și anioni ai grupărilor hidroxo OH -.
- Solubile sau alcaline (baze tari care se modifică Formate din metale din grupele I, II. Exemplu: KOH, NaOH, LiOH (adică sunt luate în considerare doar elementele principalelor subgrupe);
- Puțin solubil sau insolubil (rezistență medie, nu schimbați culoarea indicatorilor). Exemplu: hidroxid de magneziu, fier (II), (III) și altele.
- Moleculare (baze slabe, în mediu apos se disociază reversibil în ioni-molecule). Exemplu: N2H4, amine, amoniac.
- Hidroxizi amfoteri (prezintă proprietăți duble bazic-acide). Exemplu: beriliu, zinc și așa mai departe.

Fiecare grupă reprezentată este studiată la cursul școlar de chimie la secțiunea „Fundații”. Clasele de chimie 8-9 implică un studiu detaliat al alcalinelor și compușilor puțin solubili.
Principalele proprietăți caracteristice ale bazelor
Toate alcalinele și compușii puțin solubili se găsesc în natură în stare solidă cristalină. În același timp, punctele lor de topire sunt, de regulă, scăzute, iar hidroxizii slab solubili se descompun atunci când sunt încălziți. Culoarea de bază este diferită. Dacă alcaliile sunt albe, atunci cristalele de baze moleculare puțin solubile pot fi de culori foarte diferite. Solubilitatea majorității compușilor din această clasă poate fi vizualizată în tabel, care prezintă formulele de oxizi, baze, acizi, săruri, arată solubilitatea acestora.
Alcalii sunt capabili să schimbe culoarea indicatorilor după cum urmează: fenolftaleină - zmeură, metil portocaliu - galben. Acest lucru este asigurat de prezența liberă a grupărilor hidroxo în soluție. De aceea bazele puțin solubile nu dau o astfel de reacție.
Proprietățile chimice ale fiecărui grup de baze sunt diferite.
| Proprietăți chimice | ||
| alcalii | baze puțin solubile | Hidroxizi amfoteri |
I. Interacționează cu KO (total - sare și apă): 2LiOH + SO 3 = Li 2 SO 4 + apă II. Interacționează cu acizi (sare și apă): reacții convenționale de neutralizare (vezi acizi) III. Interacționează cu AO pentru a forma un hidroxocomplex de sare și apă: 2NaOH + Me + n O \u003d Na 2 Me + n O 2 + H 2 O sau Na 2 IV. Interacționează cu hidroxizii amfoteri pentru a forma săruri hidroxo complexe: La fel ca si cu AO, doar fara apa V. Interacționează cu sărurile solubile pentru a forma hidroxizi și săruri insolubile: 3CsOH + clorură de fier (III) = Fe(OH) 3 + 3CsCl VI. Interacționează cu zincul și aluminiul într-o soluție apoasă pentru a forma săruri și hidrogen: 2RbOH + 2Al + apă = complex cu ion hidroxid 2Rb + 3H 2 | I. Când sunt încălzite, se pot descompune: hidroxid insolubil = oxid + apă II. Reacții cu acizi (total: sare și apă): Fe(OH)2 + 2HBr = FeBr2 + apă III. Interacționează cu KO: Me + n (OH) n + KO \u003d sare + H 2 O | I. Reacționează cu acizii pentru a forma sare și apă: (II) + 2HBr = CuBr 2 + apă II. Reacționează cu alcalii: rezultat - sare și apă (condiție: fuziune) Zn(OH) 2 + 2CsOH \u003d sare + 2H 2 O III. Reacţionează cu hidroxizi puternici: rezultă săruri, dacă reacţia are loc într-o soluţie apoasă: Cr(OH)3 + 3RbOH = Rb3 |
Acestea sunt cele mai chimice proprietăți pe care le prezintă bazele. Chimia bazelor este destul de simplă și respectă legile generale ale tuturor compușilor anorganici.
Clasa de săruri anorganice. Clasificare, proprietăți fizice
Pe baza prevederilor ED, sărurile pot fi numite compuși anorganici care se disociază într-o soluție apoasă în cationi metalici Me + n și anioni ai reziduurilor acide An n-. Așa că vă puteți imagina sare. Chimia oferă mai mult de o definiție, dar aceasta este cea mai exactă.
În același timp, în funcție de natura lor chimică, toate sărurile sunt împărțite în:
- Acid (care conține un cation de hidrogen). Exemplu: NaHSO4.
- Bazic (avand o grupa hidroxo). Exemplu: MgOHNO3, FeOHCL2.
- Mediu (constă numai dintr-un cation metalic și un reziduu acid). Exemplu: NaCL, CaSO4.
- Dublu (include doi cationi metalici diferiți). Exemplu: NaAl(SO4)3.
- Complex (hidroxocomplexe, acvacomplexe și altele). Exemplu: K2.
Formulele sărurilor reflectă natura lor chimică și vorbesc, de asemenea, despre compoziția calitativă și cantitativă a moleculei.

Oxizii, sărurile, bazele, acizii au solubilitate diferită, care poate fi văzută în tabelul corespunzător.
Dacă vorbim despre starea de agregare a sărurilor, atunci trebuie să observați uniformitatea acestora. Ele există numai în stare solidă, cristalină sau pulbere. Schema de culori este destul de variată. Soluțiile de săruri complexe, de regulă, au culori saturate strălucitoare.
Interacțiuni chimice pentru clasa sărurilor medii
Au proprietăți chimice similare ale bazelor, acizilor, sărurilor. Oxizii, așa cum am considerat deja, diferă oarecum de ei în acest factor.
În total, se pot distinge 4 tipuri principale de interacțiuni pentru sărurile medii.
I. Interacțiunea cu acizii (numai puternici în ceea ce privește DE) cu formarea unei alte săruri și a unui acid slab:
KCNS + HCL = KCL + HCNS
II. Reacții cu hidroxizi solubili cu aspect de săruri și baze insolubile:
CuSO 4 + 2LiOH = 2LiSO 4 sare solubilă + Cu(OH) 2 bază insolubilă
III. Interacțiunea cu o altă sare solubilă pentru a forma o sare insolubilă și una solubilă:
PbCL2 + Na2S = PbS + 2NaCL
IV. Reacții cu metale în stânga celui care formează sarea în EHRNM. În acest caz, metalul care intră în reacție nu ar trebui, în condiții normale, să interacționeze cu apa:
Mg + 2AgCL = MgCl2 + 2Ag
Acestea sunt principalele tipuri de interacțiuni care sunt caracteristice sărurilor medii. Formulele de săruri complexe, bazice, duble și acide vorbesc de la sine despre specificul proprietăților chimice manifestate.

Formulele de oxizi, baze, acizi, săruri reflectă natura chimică a tuturor reprezentanților acestor clase de compuși anorganici și, în plus, oferă o idee despre numele substanței și al acesteia. proprietăți fizice. Prin urmare, o atenție deosebită trebuie acordată scrisului lor. O mare varietate de compuși ne oferă o știință în general uimitoare - chimia. Oxizi, baze, acizi, săruri - aceasta este doar o parte din marea varietate.
Oxizi se numesc substanțe complexe, a căror compoziție a moleculelor include atomi de oxigen în stare de oxidare - 2 și un alt element.
poate fi obținut prin interacțiunea directă a oxigenului cu un alt element, sau indirect (de exemplu, prin descompunerea sărurilor, bazelor, acizilor). În condiții normale, oxizii sunt în stare solidă, lichidă și gazoasă, acest tip de compuși fiind foarte comun în natură. oxizii se găsesc în Scoarta terestra. Rugina, nisipul, apa, dioxid de carbon sunt oxizi.
Ele formează sare și nu formează sare.
Oxizi formatori de sare- Aceștia sunt oxizi care formează săruri ca urmare a reacțiilor chimice. Aceștia sunt oxizi de metale și nemetale, care, atunci când interacționează cu apa, formează acizii corespunzători, iar atunci când interacționează cu bazele, sărurile acide și normale corespunzătoare. De exemplu, oxidul de cupru (CuO) este un oxid care formează sare, deoarece, de exemplu, atunci când reacţionează cu acidul clorhidric (HCl), se formează o sare:
CuO + 2HCl → CuCl2 + H2O.
Ca rezultat al reacțiilor chimice, se pot obține și alte săruri:
CuO + SO 3 → CuSO 4.
Oxizi care nu formează sare numiti oxizi care nu formeaza saruri. Un exemplu este CO, N2O, NO.
Oxizii care formează sare, la rândul lor, sunt de 3 tipuri: bazici (din cuvântul «
baza »
), acid și amfoter.
Oxizii bazici se numesc astfel de oxizi metalici, care corespund hidroxizilor aparținând clasei bazelor. Oxizii bazici includ, de exemplu, Na2O, K2O, MgO, CaO etc.
 Proprietățile chimice ale oxizilor bazici
Proprietățile chimice ale oxizilor bazici
1. Oxizii bazici solubili în apă reacţionează cu apa pentru a forma baze:
Na2O + H2O → 2NaOH.
2. Interacționează cu oxizii acizi, formând sărurile corespunzătoare
Na 2 O + SO 3 → Na 2 SO 4.
3. Reacționează cu acizii pentru a forma sare și apă:
CuO + H2SO4 → CuSO4 + H2O.
4. Reacționează cu oxizi amfoteri:
Li 2 O + Al 2 O 3 → 2LiAlO 2 .
Dacă al doilea element din compoziția oxizilor este un nemetal sau un metal care prezintă o valență mai mare (de obicei prezintă de la IV la VII), atunci astfel de oxizi vor fi acizi. Oxizii acizi (anhidride acide) sunt oxizi care corespund hidroxizilor aparținând clasei de acizi. Acesta este, de exemplu, CO 2 , SO 3 , P 2 O 5 , N 2 O 3 , Cl 2 O 5 , Mn 2 O 7 etc. Oxizii acizi se dizolvă în apă și alcalii, formând sare și apă.
Proprietățile chimice ale oxizilor acizi
1. Interacționează cu apa, formând acid:
SO3 + H2O → H2SO4.
Dar nu toți oxizii acizi reacționează direct cu apa (SiO 2 și altele).
2. Reacționează cu oxizii pe bază pentru a forma o sare:
CO 2 + CaO → CaCO 3
3. Interacționează cu alcalii, formând sare și apă:
CO2 + Ba (OH)2 → BaCO3 + H2O.
Parte oxid amfoter include un element care are proprietăți amfotere. Amfoteritatea este înțeleasă ca capacitatea compușilor de a prezenta proprietăți acide și bazice în funcție de condiții. De exemplu, oxidul de zinc ZnO poate fi atât o bază, cât și un acid (Zn(OH)2 și H2ZnO2). Amfoteritatea se exprimă prin faptul că, în funcție de condiții, oxizii amfoteri prezintă proprietăți fie bazice, fie acide.
Proprietățile chimice ale oxizilor amfoteri
1. Interacționează cu acizii pentru a forma sare și apă:
ZnO + 2HCl → ZnCl2 + H2O.
2. Reacționează cu alcalii solide (în timpul fuziunii), formând ca rezultat al reacției sare - zincat de sodiu și apă:
ZnO + 2NaOH → Na2ZnO2 + H2O.
Când oxidul de zinc interacționează cu o soluție alcalină (același NaOH), are loc o altă reacție:
ZnO + 2 NaOH + H2O => Na2.
Numărul de coordonare - o caracteristică care determină numărul de particule cele mai apropiate: atomi sau ioni dintr-o moleculă sau un cristal. Fiecare metal amfoter are propriul său număr de coordonare. Pentru Be și Zn este 4; Pentru și Al este 4 sau 6; Pentru și Cr este 6 sau (foarte rar) 4;
Oxizii amfoteri de obicei nu se dizolvă în apă și nu reacţionează cu aceasta.
Aveti vreo intrebare? Vrei să afli mai multe despre oxizi?
Pentru a obține ajutorul unui tutor - înregistrați-vă.
Prima lecție este gratuită!
site-ul, cu copierea integrală sau parțială a materialului, este necesară un link către sursă.
 Care verb se termină cu e?
Care verb se termină cu e? Biografie Tatyana Vizel Fundamentele neuropsihologiei
Biografie Tatyana Vizel Fundamentele neuropsihologiei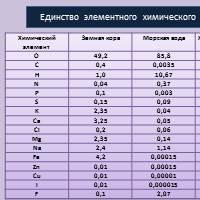 Compoziția chimică a celulei
Compoziția chimică a celulei Astakhov Pavel Alekseevich, avocat: biografie, viață personală, carieră
Astakhov Pavel Alekseevich, avocat: biografie, viață personală, carieră Scurte informații despre Sinoadele ecumenice
Scurte informații despre Sinoadele ecumenice Biserica Sf. Nicolae Făcătorul de Minuni de pe Bersenevka
Biserica Sf. Nicolae Făcătorul de Minuni de pe Bersenevka Cine a inventat alfabetul rus?
Cine a inventat alfabetul rus?